
【題目】某化學小組在實驗室制取 Na2O2。查閱資料可知:鈉與空氣在 453473K 之間可生成 Na2O,迅速提高溫度到 573673K 之間可生成 Na2O2,若溫度提高到 733873K 之間 Na2O2 可分解。
(1)甲組設計制取 Na2O2 裝置如圖1。
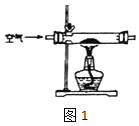
①使用該裝置制取的 Na2O2 中可能含有的雜質為_____。.
A.NaCl B.Na2CO3 C.Na2O D.NaOH E.NaHCO3
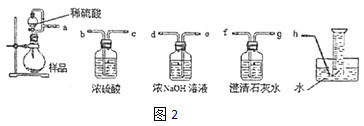
②該小組為測定制得的 Na2O2 樣品的純度,設計可能用到的裝置如圖 2:燒瓶中發(fā)生的主要反應的化學方程式是_________。測定裝置的接口從 左至右正確的連接順序是_____。
(2)乙組從反應歷程上分析該測定反應存在中間產物,從而導致測定結果_____ (填“偏大”或“偏 小”)。為證明其分析的正確性,設計實驗方案如下:
實驗方案 | 產生的現(xiàn)象 |
Ⅰ.取燒瓶中的反應液加入少量 MnO2 粉末 | 有大量氣泡逸出 |
Ⅱ.向 NaOH 稀溶液中加入 23 滴酚酞試液,然后加入少量的反應液 | 溶液先變紅后褪色開始無明顯現(xiàn)象。 |
Ⅲ.向反應液中加入 23 滴酚酞試液,充分振蕩,然后逐滴加入 過量的 NaOH 稀溶液 | 加 NaOH 溶液先 變紅后褪色 |
在上述實驗中,能夠證明乙組分析正確的最佳方案是_________ (填實驗序號)。_______________組實驗得不出結論,原因是_____。
(3)丙組根據(jù)上述提供的有關信息,設計一個方案可準確的測定樣品的純度。請簡述實驗操作和需 要測定的有關數(shù)據(jù)__________________________________
【答案】BCD 2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O aedfgh 偏小 I II II 中有硫酸存在,所以溶液褪色的原因不一定是被漂白 稱取一定質量的樣品(m),加熱 733873K 使之分解,用量氣裝置測定常溫常壓下生成氧氣體積(V),然后進行有關計算
【解析】
(1)①鈉與氧氣反應可以得到氧化鈉、過氧化鈉,二者均與二氧化碳反應得到碳酸鈉,與水反應會得到氫氧化鈉,而碳酸氫鈉受熱分解;
②燒瓶中過氧化鈉與硫酸反應生成硫酸鈉、氧氣與水;用濃氫氧化鈉溶液吸收可能氧氣中混有二氧化碳,澄清石灰水檢驗二氧化碳是否除盡,用排水法收集氧氣,根據(jù)氧氣體積可以計算過氧化鈉的質量,進而計算樣品中過氧化鈉的質量分數(shù);
(2)實驗I說明中間產物為過氧化氫,且過氧化氫沒有完全分解為氧氣,導致測定氧氣體積偏小;
實驗Ⅱ:反應后的溶液中有硫酸剩余,可以使紅色酚酞溶液褪色;
實驗Ⅲ:加入的氫氧化鈉先中和剩余的硫酸,過量的氫氧化鈉式溶液顯紅色,過氧化氫具有強氧化性,又使溶液紅色褪去;
(3)稱取一定質量的樣品(m),加熱733873使之分解,用量氣裝置測定常溫常壓下生成氧氣體積(V),然后進行有關計算,或者稱取一定質量的樣品(m),進入少量二氧化錳,再加入足量的水,用量氣裝置測定常溫常壓下生成氧氣體積(V),然后進行有關計算。
(1)①鈉與氧氣反應可以得到氧化鈉、過氧化鈉,二者均與二氧化碳反應得到碳酸鈉,與水反應會得到氫氧化鈉,由信息可以知道鈉與氮氣不反應,而碳酸氫鈉受熱分解,Na2O2 中可能含有的雜質為Na2CO3、Na2O、NaOH,
因此,本題正確答案是:BCD;
②燒瓶中過氧化鈉與硫酸反應生成硫酸鈉、氧氣與水,反應方程式為:2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O ,
用濃氫氧化鈉溶液吸收可能氧氣中混有二氧化碳,澄清石灰水檢驗二氧化碳是否除盡,用排水法收集氧氣,根據(jù)氧氣體積可以計算過氧化鈉的質量,進而計算樣品中過氧化鈉的質量分數(shù),測定裝置的接口從左至右正確的連接順序是aedfgh,
因此,本題正確答案是:2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O;aedfgh;
(2) 實驗I說明中間產物為過氧化氫,且過氧化氫沒有完全分解為氧氣,導致測定氧氣體積偏小,所以能夠證明乙組分析正確的最佳方案是實驗I;
實驗Ⅱ:反應后的溶液中有硫酸剩余,可以使紅色酚酞溶液褪色,所以溶液褪色的原因不一定是被漂白;
實驗Ⅲ:加入的氫氧化鈉先中和剩余的硫酸,過量的氫氧化鈉式溶液顯紅色,過氧化氫具有強氧化性,又使溶液紅色褪去,反應溶液中存在的中間產物與酚酞作用的條件是堿性條件,
因此,本題正確答案是:偏小;I;II ;I 中有硫酸存在,所以溶液褪色的原因不一定是被漂白;
(3) 稱取一定質量的樣品(m),加熱733873使之分解,用量氣裝置測定常溫常壓下生成氧氣體積(V),然后進行有關計算,或者稱取一定質量的樣品(m),進入少量二氧化錳,再加入足量的水,用量氣裝置測定常溫常壓下生成氧氣體積(V),然后進行有關計算,
因此,本題正確答案是:稱取一定質量的樣品(m),加熱 733873K 使之分解,用量氣裝置測定常溫常壓下生成氧氣體積(V),然后進行有關計算。


科目:高中化學 來源: 題型:
【題目】下列物質分類的正確組合是( )
堿 | 酸 | 鹽 | 酸性氧化物 | |
A | 純堿 | 鹽酸 | 燒堿 | 二氧化硫 |
B | 燒堿 | 硫酸 | 食鹽 | 一氧化碳 |
C | 苛性鈉 | 醋酸 | 石灰石 | 水 |
D | 苛性鉀 | 碳酸 | 蘇打 | 三氧化硫 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】治療癌癥的有機小分子酯類藥物X被批準使用。以芳香族化合物A為主要原料合成X的路線如下:
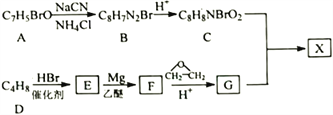
已知:
①核磁共振氫譜顯示A有3種化學環(huán)境的氫,E只有1種化學環(huán)境的氫;
②![]()
③![]()
回答下列問題:
(1)A的名稱是______________________;G中官能團名稱是____________________。
(2)C在一定條件下反應生成高分子化合物,該反應的化學方程式為:__________________________。
(3)D生成E的反應類型為_____________________。
(4)X的結構簡式為_____________________。
(5)已知:同一個碳原子若連有兩個—OH時,易轉化成![]() 。H是C的同分異構體,寫出兩種滿足下列要求的H的結構簡式______________________。
。H是C的同分異構體,寫出兩種滿足下列要求的H的結構簡式______________________。
①苯環(huán)上有兩個取代基;
②能發(fā)生銀鏡反應,且在堿性條件下水解的兩種產物也能發(fā)生銀鏡反應。
(6)參照上述合成路線和信息,用乙烯、乙醚、環(huán)氧乙烷為原料(其他無機試劑任選)合成1,6-己二酸_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗現(xiàn)象和解釋或結論都正確的是
選項 | 實驗操作 | 實驗現(xiàn)象 | 解釋或結論 |
A | 將充滿NO2的密閉玻璃球浸泡在熱水中 | 紅棕色變深 | 反應2NO2 |
B | 淀粉水解后的溶液加入新制Cu(OH)2濁液,再加熱 | 無磚紅色沉淀 | 淀粉水解產物不含醛基 |
C | 用鉑絲蘸取少量溶液進行焰色反應 | 火焰呈黃色 | 該溶液是鈉鹽溶液 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振蕩,再加入10滴0.1 nol/L的NaI溶液,再振蕩, | 先生成白色沉淀,后產生黃色沉淀 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向lL0.lmol·L-1一元酸HR溶液中逐漸通人氨氣[已知常溫下Kb(NH3H2O)=1.76×10-5],使溶液溫度和體積保持不變,混合溶液的pH與離子濃度變化的關系如右圖所示。下列敘述正確的是( )
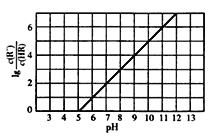
A. 0.1 mol·L-1HR溶液的pH約為3
B. HR為弱酸,常溫時Ka (HR)=1×l0-7
C. 當通入0.1molNH3時,c(R-)>c(NH4+)
D. 當c(HR) =c(R-)時,溶液必為中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某白色粉末A在農業(yè)上用作殺菌劑,進行下列實驗:
①:白色粉末A溶解在水中,得到藍色溶液,分成等量的兩份
②:在其中一份藍色溶液中加入適量的鹽溶液B,恰好沉淀完全,過濾,得到白色沉淀和藍色溶液;在此藍色溶液中滴加酸化的AgNO3溶液又得到白色沉淀和藍色溶液;
③:在①中的另一份藍色溶液中加入適量C溶液,恰好沉淀完全,過濾,得到藍色沉淀和純凈的硫酸鉀溶液。
根據(jù)實驗現(xiàn)象推斷:
(1)A______________ B_______________ C_______________(填化學式)
(2)反應③中的離子方程式為__________________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機物的說法正確的是
A. 乙醇和乙酸均可與NaOH溶液發(fā)生酸堿中和反應
B. 苯分子中存在典型的碳碳雙鍵,可發(fā)生加成反應
C. 苯分子能發(fā)生取代反應
D. 加熱銀氨溶液與淀粉溶液的混合液可用于檢驗淀粉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅是重要金屬,Cu的化合物在科學研究和工業(yè)生產中具有許多用途,如CuSO4溶液常用作電解液、電鍍液等。請回答以下問題:
(1)CuSO4可由金屬銅與濃硫酸反應制備,該反應的化學方程式為________________________________________________________________________。
(2)CuSO4粉末常用來檢驗一些有機物中的微量水分,其原因是________________________________________________________________________。
(3)SO![]() 中S以sp3雜化,SO
中S以sp3雜化,SO![]() 的立體構型是________。
的立體構型是________。
(4)元素金(Au)處于周期表中的第六周期,與Cu同族,金原子最外層電子排布式為____________。一種銅合金晶體具有立方最密堆積的結構,在晶胞中銅原子處于面心,金原子處于頂點位置,則該合金中銅原子與金原子數(shù)量之比為________;該晶體中,原子之間的作用力是________________________________________________________________________。
(5)CuSO4晶體的構成微粒是________和________,微粒間的作用力是________,該晶體屬于________晶體。
(6)上述晶體具有儲氫功能,氫原子可進入到由銅原子與金原子構成的四面體空隙中。若將銅原子與金原子等同看待,該晶體儲氫后的晶胞結構與CaF2的結構相似,該晶體儲氫后的化學式應為________。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com