
【題目】某研究小組為比較Al和Fe的金屬性強弱,設計了圖1所示的裝置,甲中錐形瓶內盛放的是100ml稀鹽酸(反應前后溶液體積變化可以忽略不計). 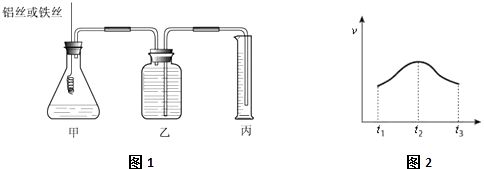
(1)若要比較產生氣體的快慢有兩種方法,一種是比較產生相同體積氣體所需的時間,另一種是比較;
(2)實驗測得產生氣體的速率(v)與時間(t)的關系如圖2所示,則t1~t2時間內速率逐漸加快說明該反應是(填放熱或吸熱)反應,t2~t3時間內速率逐漸減慢的主要原因是;
(3)如果在相同條件下,把甲錐形瓶內盛放稀鹽酸改成H+濃度相同的稀硫酸,發現反應會比原來慢許多,原因可能是;(寫出合理的一種即可)
【答案】
(1)相同時間內產生氣體體積大小
(2)放熱;鹽酸濃度不斷減小
(3)Cl﹣會促進該反應的進行,(或SO42﹣抑制該反應的進行)
【解析】解:(1)由v= ![]() 知,反應速率與氣體的體積和時間有關,所以一種是固定體積比較時間,另一種是固定時間比較體積,所以答案是:相同時間內產生氣體體積大小;(2)該反應是一個放熱的反應,隨著反應的進行,放出的熱量越多,溶液的溫度越高,溫度越高反應速率越大;隨著反應的進行,溶液中鹽酸的濃度不斷減小,濃度越小反應速率越小,
知,反應速率與氣體的體積和時間有關,所以一種是固定體積比較時間,另一種是固定時間比較體積,所以答案是:相同時間內產生氣體體積大小;(2)該反應是一個放熱的反應,隨著反應的進行,放出的熱量越多,溶液的溫度越高,溫度越高反應速率越大;隨著反應的進行,溶液中鹽酸的濃度不斷減小,濃度越小反應速率越小,
所以答案是:放熱;鹽酸濃度不斷減小;(3)鹽酸和稀硫酸具有相同的陽離子H+ , 稀鹽酸改成H+濃度相同的稀硫酸,發現反應會比原來慢許多,可能為Cl﹣會促進該反應的進行,(或SO42﹣抑制該反應的進行),
所以答案是:Cl﹣會促進該反應的進行,(或SO42﹣抑制該反應的進行).
【考點精析】通過靈活運用吸熱反應和放熱反應,掌握化學上把吸收熱量的化學反應稱為吸熱反應;化學上把放出熱量的化學反應稱為放熱反應即可以解答此題.


科目:高中化學 來源: 題型:
【題目】下列依據熱化學方程式得出的結論正確的是( )
A. 常溫常壓下,1 g H2在足量Cl2中燃燒生成HCl,放出92.3 kJ的熱量,則熱化學方程式可表示為H2(g)+Cl2(g)2HCl(g) ΔH=+184.6 kJ·mol-1
B. 甲烷的標準燃燒熱為ΔH=-890.3 kJ·mol-1,則甲烷燃燒的熱化學方程式可表示為CH4(g)+2O2(g)CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
C. 已知NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,則含20.0 g NaOH的稀溶液與稀鹽酸完全中和,放出28.7 kJ的熱量
D. 相同條件下,2 mol氫原子所具有的能量小于1 mol氫分子所具有的能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在溫度不變的條件下,在恒容的容器中進行下列反應:N2O4(g)═2NO2(g),若N2O4的濃度由0.1molL﹣1降到0.07molL﹣1需要15s,那么N2O4的濃度由0.07molL﹣1降到0.05molL﹣1所需的反應時間( )
A.等于5s
B.等于10s
C.小于10s
D.大于10s
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車、飛機等交通工具排放的尾氣中含有的大量CO、NO 等大氣污染物,是造成霧霾天氣的主要原因,研究CO、NO 的轉化對于環境的改善有重大意義。
(1)有人設想將CO按下列反應除去:2CO(g)=2C(s) +O2(g) △H>0。你認為該設想能否實現并說明理由:__________________________。
(2)用活性炭還原法可以處理汽車尾氣中的氮氧化物。某研究小組在2 L的恒容密閉容器中加人0.100 mL NO 和2.030 mol固體活性炭,發生反應:C(s)+2NO(g) ![]() N2(g)+CO2(g)。在不同溫度下測得平衡體系中各物質的物質的量如下表:
N2(g)+CO2(g)。在不同溫度下測得平衡體系中各物質的物質的量如下表:
T/℃ | n(固體活性炭)/mol | n(NO)/mol | n(N2)/mol | n(CO2)/mol |
200 | 2.000 | 0.040 | 0.030 | 0.030 |
350 | 2.005 | 0.050 | 0.025 | 0.025 |
①該反應的正反應為___________(填“吸熱”或“放熱”)反應。
②200℃時,反應達到平衡后向恒容容器中再充入0.100 mol NO,再次達到平衡后,混合氣中NO的百分含量將__________(填“增大”“減小”或“不變”)。
③上述反應在350℃時的平衡常數K=_______________。
(3)在密閉容器中發生上述反,,達到平衡時,下列措施能提高NO轉化率的是___________(填字母)。
A.選用更高效的催化劑 B.增加C(s)的量
C.降低反應體系的溫度 D.縮小容器的體積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用硫及其化合物制硫酸有下列三種反應途徑,某些反應條件和產物已省略。下列有關說法不正確的是( )

A. 途徑①的反應中體現了濃HNO3的強氧化性
B. 途徑②、③的第二步反應在實際生產中可以通過增大O2的濃度來低成本
C. 由途徑①、②、③分別制取1molH2SO4,理論上各消耗1molS,各轉移6mole-
D. 途徑②、③比途徑①污染相對小且原子利用率高,更能體現“綠色化學”的理論
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.通常元素的化合價與其原子的質量數有密切的關系
B.已知銥的一種核素是 ![]() Ir,則其核內的中子數是114
Ir,則其核內的中子數是114
C.![]() C和
C和 ![]() N的質量數相同,但質子數不同,所以互稱為同位素
N的質量數相同,但質子數不同,所以互稱為同位素
D.鉀的原子結構示意圖為 ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2000年諾貝爾化學獎被授予白川英樹等三位科學家,以表彰他們在導電聚合物這一領域所做的開創性工作,他們發現含…-CH=CH-CH=CH-CH=CH-…這種結構的聚合物具有導電性,合成上述這種結構聚合物的物質是( )
A.乙炔B.乙烯C.丁烯D.乙烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于物質或離子檢驗的判斷正確的是( )
A.向溶液中滴加酚酞試液,溶液顯紅色:原溶液是NaOH
B.氣體通過無水硫酸銅,粉末變藍:原氣體中含有水蒸氣
C.灼燒白色粉末,火焰呈黃色:原粉末是鈉鹽
D.將氣體通入澄清石灰水,溶液變渾濁:原氣體是CO2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com