
【題目】某課外興趣小組探究利用廢銅屑制取CuSO4溶液,設計了以下幾種實驗方案。完成下列填空:
(1)方案一:以銅和濃硫酸反應制備硫酸銅溶液。方案二:將廢銅屑在空氣中灼燒后再投入稀硫酸中。和方案一相比,方案二的優點是________________________;方案二的實驗中,發現容器底部殘留少量紫紅色固體,再加入稀硫酸依然不溶解,該固體為________。
(2)方案三的實驗流程如圖所示。
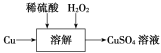
溶解過程中有氣體放出,該氣體是________。隨著反應的進行,生成氣體速率加快,推測可能的原因是________________________________________________________________________________。
(3)設計實驗證明你的推測:______________________________。
方案四的實驗流程如圖所示。
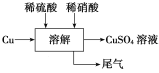
(4)為了得到較純凈的硫酸銅溶液,硫酸和硝酸的物質的量之比應為________;
(5)對方案四進行補充完善,設計一個既能防止污染,又能實現物料循環的實驗方案(用流程圖表示)__________________________________。
【答案】不產生污染空氣的SO2氣體,制取等量的CuSO4溶液,消耗的硫酸量少 Cu O2 反應產生的Cu2+對H2O2分解有催化作用 取H2O2溶液,向其中滴加CuSO4溶液,觀察產生氣泡的速率是否加快 3∶2 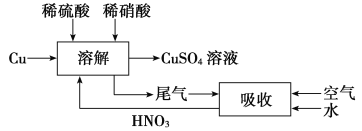
【解析】
(1)第一個方案中放出的有毒氣體二氧化硫會造成空氣污染;第二個方案中銅和氧氣加熱生成氧化銅,氧化銅和硫酸反應產生硫酸銅和水,因此反應過程中沒有污染物,且原料的利用率高。方案二的實驗中,發現容器底部殘留少量紫紅色固體為銅,不溶于稀硫酸;(2)方案三中H2O2發生還原反應生成O2;隨著反應的進行,生成氣體速率加快,可能是反應產生的Cu2+對H2O2分解有催化作用;(3)取H2O2溶液,向其中滴加CuSO4溶液,如果產生氣泡的速率加快,則證明Cu2+對H2O2分解有催化作用;(4)根據離子方程式:3Cu+2NO![]() +8H+===3Cu2++2NO↑+4H2O,反應消耗2 mol硝酸,生成3 mol硫酸銅,故為了得到較純凈的硫酸銅溶液,硫酸和硝酸的物質的量之比應為3∶2;(5)設計實驗方案時,為防止NO污染空氣,應通入空氣氧化NO為NO2,用水吸收后,生成的HNO3再循環利用:
+8H+===3Cu2++2NO↑+4H2O,反應消耗2 mol硝酸,生成3 mol硫酸銅,故為了得到較純凈的硫酸銅溶液,硫酸和硝酸的物質的量之比應為3∶2;(5)設計實驗方案時,為防止NO污染空氣,應通入空氣氧化NO為NO2,用水吸收后,生成的HNO3再循環利用: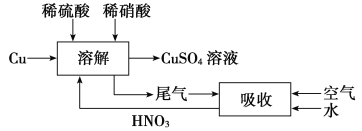 。
。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】以FeCl3溶液為實驗對象,探究其與堿性物質之間反應的復雜多樣性。實驗如下:
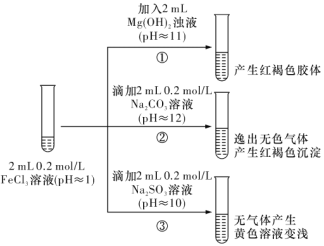
(1)①中反應的離子方程式是__________。
(2)②中逸出的無色氣體是____________(寫化學式)。
(3)對于③中的實驗現象,同學們有諸多猜測,繼續進行實驗:
甲組:取③中反應后溶液少許,滴人稀鹽酸酸化,再滴加 BaCl2溶液,產生白色沉淀。得出結論:FeCl3與 Na2SO3 發生了氧化還原反應,離子方程式是_________。
乙組:認為甲組的實驗不嚴謹,重新設計并進行實驗,證實了甲組的結論是正確的。其實驗方案是______。
(4)由上述實驗可知,下列說法正確的是___________ (填字母)。
a.鹽與堿反應時,鹽和堿都必須可溶于水
b.鹽溶液可能呈中性、堿性、酸性
c.鹽與鹽反應時,不一定生成兩種新鹽
d.鹽與鹽反應時,發生的不一定是復分解反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒溫密閉容器中制備特種陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)﹣Q,達到平衡后,以下分析正確的是( )
A.加入硫酸鎂固體,平衡正向移動
B.達到平衡時,氣體的平均分子量保持不變
C.保持體積不變,充入CO,達到平衡的過程中逆反應速率逐漸增大
D.1mol MgSO4和1mol CO反應,達到平衡時吸收熱量為Q
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是( )
A. 苯酚鈉溶液中通入少量的二氧化碳,產物是苯酚和碳酸鈉
B. 苯的同系物中,苯環和側鏈相互影響,使得二者均易被氧化
C. ![]() 在核磁共振氫譜中出現兩組峰,其氫原子數之比為3:2
在核磁共振氫譜中出現兩組峰,其氫原子數之比為3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能處于同一平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A 是農藥生產中的一種中間體,結構簡式如下圖所示。下列敘述中正確的是
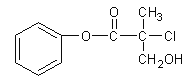
A.1mol A最多能與4mol H2發生加成反應
B.有機物A可以在一定條件下與HBr發生反應
C.有機物A與濃硫酸混合加熱,可以發生消去反應
D.1mol A與足量的NaOH溶液反應,最多可以消耗2mol NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】淀粉水解的產物(C6H12O6)用硝酸氧化可以制備草酸,裝置如圖1所示(加熱、攪拌和儀器固定裝置均已略去):實驗過程如下:
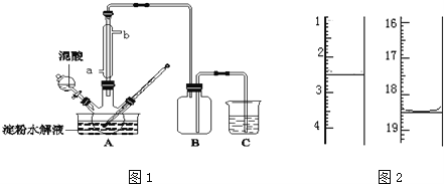
①將1:1的淀粉水乳液與少許硫酸(98%)加入燒杯中,水浴加熱至85℃~90℃,保持30min,然后逐漸將溫度降至60℃左右;
②將一定量的淀粉水解液加入三頸燒瓶中;
③控制反應液溫度在55~60℃條件下,邊攪拌邊緩慢滴加一定量含有適量催化劑的混酸(65%HNO3與98%H2SO4的質量比為2:1.5)溶液;
④反應3h左右,冷卻,減壓過濾后再重結晶得草酸晶體,硝酸氧化淀粉水解液過程中可發生下列反應:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
請回答下列問題:
(1)實驗①加入98%硫酸少許的作用是:_________;
(2)實驗中若混酸滴加過快,將導致草酸產量下降,其原因是_________;
(3)檢驗淀粉是否水解完全所用的試劑為_________;
(4)草酸重結晶的減壓過濾操作中,除燒杯、玻璃棒外,還必須使用屬于硅酸鹽材料的儀器有_________;
(5)將產品在恒溫箱內約90℃以下烘干至恒重,得到二水合草酸.用KMnO4標準溶液滴定,該反應的離子方程式為:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O稱取該樣品0.12g,加適量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至終點(雜質不參與反應),此時溶液顏色變化為_________,滴定前后滴定管中的液面讀數如圖2所示,則該草酸晶體樣品中二水合草酸的質量分數為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在通風櫥中進行下列實驗:
步驟 |
|
| |
現象 | Fe表面產生大量無色氣泡,液面上方變為紅棕色 | Fe表面產生少量紅棕色氣泡后,迅速停止 | Fe、Cu接觸后,其表面均產生紅棕色氣泡 |
下列說法不正確的是
A. I中氣體由無色變紅棕色的化學方程式:2NO+O2=2NO2
B. II中的現象說明Fe表面形成致密的氧化層,阻止Fe進一步反應
C. 對比I、II中現象,說明稀HNO3的氧化性強于濃HNO3
D. 針對Ⅲ中現象,在Fe、Cu之間連接電流計,可判斷Fe是否被氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】芳香族化合物C的分子式為C9H9OCl。C分子中有一個甲基且苯環上只有一條側鏈;一定條件下C能發生銀鏡反應;
C與其他物質之間的轉化如下圖所示:
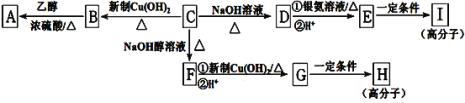
(1)C的結構簡式是__________________。
(2)E中含氧官能團的名稱是___________; C→F的反應類型是___________。
(3)寫出下列化學方程式:G在一定條件下合成H的反應________________________。
(4)D的一種同系物W(分子式為C8H8O2)有多種同分異構體,則符合以下條件W的同分異構體有________種,寫出其中核磁共振氫譜有4個峰的結構簡式____________。
①屬于芳香族化合物 ②遇FeCl3溶液不變紫色 ③能與NaOH溶液發生反應但不屬于水解反應
(5)請設計合理方案由![]() 合成
合成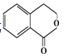 __________(無機試劑任選,用反應流程圖表示,并注明反應條件)。
__________(無機試劑任選,用反應流程圖表示,并注明反應條件)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖(1)和圖(2)是A、B兩種物質的核磁共振氫譜。已知A、B兩種物質都是烴類,都含有6個氫原子。請根據圖(1)和圖(2)兩種物質的核磁共振氫譜圖選擇出可能屬于圖(1)和圖(2)的兩種物質( )
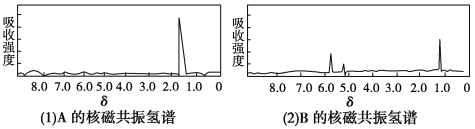
A. A是C3H6;B是C6H6
B. A是C2H6;B是C3H6
C. A是C2H6;B是C6H6
D. A是C3H6;B是C2H6
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com