
【題目】已知反應A+3B=2C+D在某段時間內以A的濃度變化表示的化學反應速率為2 mol·L-1·s-1,則此段時間內用B的濃度變化表示的化學反應速率為( )。
A.5 mol·L-1·s-1 B.6 mol·L-1·s-1 C.2 mol·L-1·s-1 D.3 mol·L-1·s-1
科目:高中化學 來源: 題型:
【題目】在容積為2L的密閉容器中進行如下反應:A(g)+2B(g)3C(g)+nD(g),開始時A為4mol,B為6mol;5min后達到化學平衡,此時C的物質的量為3mol,用D表示的化學反應速率v(D)為0.2mol/(Lmin).
(1)5min末B的物質的量濃度為
(2)前5min內化學反應速率v(A)為
(3)化學方程式中n值為
(4)該反應在此溫度下的平衡常數K=(填數值).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.用惰性電極電解200 mL一定濃度的硫酸銅溶液,實驗裝置如圖①所示,電解過程中的實驗數據如圖②所示,橫坐標表示電解過程中轉移電子的物質的量,縱坐標表示電解過程中產生氣體的總體積(標準狀況)。

(1)下列說法正確的是______(填序號)。
A.電解過程中,b電極表面先有紅色物質析出,后有氣泡產生
B.a電極上發生的反應為2H++2e-==H2↑和4OH--4e-==2H2O+O2↑
C.從P點到Q點時收集到的混合氣體的平均摩爾質量為12 g·mol-1
D.OP段表示H2和O2混合氣體的體積變化,PQ段表示O2的體積變化
(2)如果向所得的溶液中加入0.1 mol Cu(OH)2后,使溶液恰好恢復到電解前的濃度和pH,電解過程中轉移的電子為________mol。
(3)如果向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,使溶液恰好恢復到電解前的濃度和pH(不考慮CO2的溶解),電解過程中轉移的電子為________mol。
Ⅱ. 金屬腐蝕是我們日常生活的常見現象(如圖所示)。

(1)如圖銅板上鐵鉚釘處的腐蝕屬于____腐蝕。
(2)分析此腐蝕過程,下列有關說法中,不正確的是____。
A.正極電極反應式為:2H++2e-=H2↑
B.此過程中還涉及到反應:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此過程中銅并不被腐蝕
D.此過程中電子從Fe移向Cu
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用0.10mol/L的氨水滴定10.00mL a mol/L的鹽酸,混合溶液的pH與氨水的體積(V)的關系如圖所示。已知N點溶液中存在:c(H+)=c(0H-)+c(NH3H2O),下列說法不正確的是
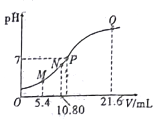
A. 圖上四點離子種類相同
B. a=0.108
C. N、Q兩點的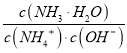 : N>Q
: N>Q
D. M點溶液中存在:c(H+)=c(OH-)+2(NH3H2O) +c(NH4+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C8H18經多步裂化,最后完全轉化為C4H8、C3H6、C2H4、C2H6、CH4五種氣體的混合物.該混合物的平均相對分子質量可能是( )
A.28
B.30
C.38
D.40
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為某城市某日空氣質量報告,下列敘述與報告內容不相符的是

A. 該日空氣首要污染物是PM10
B. 該日空氣質量等級屬于中度污染
C. 污染物NO2、CO可能主要來源于機動車尾氣
D. PM2.5、PM10指的是懸浮顆粒物,會影響人體健康
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了改善環境,科學家投入了大量的精力研究碳、氮及其化合物的轉化。請回答下列有關問題:
(1)利用N2與H2合成氨是重要的工業反應,下圖為反應過程中的能量變化關系。
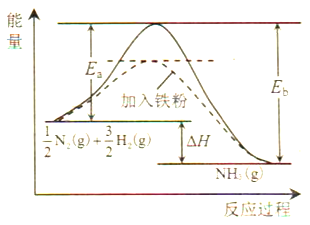
①反應中加入鐵粉可以提高反應速率,其原因是____________。
②已知某些化學鍵鍵能數據如下表:
化學鍵 | H-H | N≡N | N-H |
E/(kJ/mol) | 436 | 946 | 391 |
反應![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea=254kJ/mol,則反應NH3(g)
NH3(g)的活化能Ea=254kJ/mol,則反應NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Eb=______kJ/mol。
H2(g)的活化能Eb=______kJ/mol。
(2)汽車內燃機工作時會將N2轉化為NO,反應式為N2(g)+O2(g) ![]() 2NO(g),該反應在不同溫度下的平衡常數K如下表:
2NO(g),該反應在不同溫度下的平衡常數K如下表:
溫度 | 27℃ | 2000℃ |
K | 3.8×10-31 | 0.1 |
溫度為2000℃,某時刻測得反應體系中各物質的濃度分別為c(N2)=0.2mol/L,c(O2)=0.03mol/L,c(NO)=0.03mol/L,此時該反應的速率(v)應滿足的關系為_______(填字母序號)。
A.v正>v逆 B.v正=v逆 C.v正<v逆 D.無法確定
(3)工業上可將CO轉化成甲醇,反應式為:CO(g)+2H2(g)![]() CH3OH(g)。若在一容積可變的密閉容器中充入1molCO和2molH2進行反應,初始體積為3L,保持壓強不變,反應后CO
CH3OH(g)。若在一容積可變的密閉容器中充入1molCO和2molH2進行反應,初始體積為3L,保持壓強不變,反應后CO
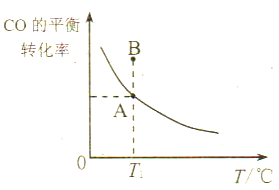
①若所加的CO和H2的量以及反應溫度均不變,則達到平衡狀態A、B時的壓強pA____pB(填“>”、“<”或“=”),其原因是___________________。
②若達到化學平衡狀態A時,CO的體積分數為25%,此時CO的轉化率為_____;平衡常數KA=________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com