
【題目】FeSO4受熱分解的化學方程式為: 2FeSO4Fe2O3+SO2↑+SO3↑
請回答:
(1)將FeSO4受熱產生的氣體按圖示裝置進行實驗,證實含有SO3和SO2。能說明SO2存在的實驗現象是;為測定BaSO4沉淀的質量,后續的操作步驟依次為、洗滌、干燥、稱重。
(2)設計一個實驗方案,用化學方法驗證FeSO4受熱后固體的成分(不考慮其他反應)。
【答案】
(1)品紅溶液褪色;過濾
(2)取適量固體,家足量的稀鹽酸溶解,分成兩份,一份中滴加KSCN溶液,若是血紅色,則有Fe3+ , 說明含有Fe2O3 ;另外一份滴加BaCl2溶液,若有白色沉淀,則有SO42- , 說明含有未分解的FeSO4
【解析】解:本題的難點在于受熱后固體成分的分析,易忽略未分解FeSO4的檢驗,可以檢驗Fe2+ 或SO42- , 前者受Fe3+干擾不易檢驗,所以檢驗SO42-的存在。答題時需要注意語言的規范性,答題模式為“取少量·····,加鹽酸溶解,滴加······試劑,出現···現象,得出······結論”,需要多種離子檢驗時考慮分成多份分別檢驗。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】現有下列物質:①干冰 ②NaHCO3晶體③氨水④純醋酸⑤FeCl3溶液 ⑥銅 ⑦Fe(OH)3膠體 ⑧蔗糖,
(1)其中屬于電解質的是 ,
(2)寫出FeCl3的電離方程式: ,
(3)寫出NaHCO3(aq)與稀鹽酸反應的離子方程式: ,
(4)膠體是一種常見的分散系,回答下列問題.①向煮沸的蒸餾水中逐滴加入飽和FeCl3溶液,繼續煮沸至溶液呈紅褐色,停止加熱,可制得Fe(OH)3膠體,制取Fe(OH)3膠體化學反應方程式為 .
②向Fe(OH)3膠體中加入Na2SO4飽和溶液,由于離子(填離子符號)的作用,使膠體形成了沉淀,這個過程叫做膠體的聚沉.
③區分膠體和溶液常用的方法叫做 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在Na2O2與CO2的反應中,下列說法正確的是
A.該反應中Na2O2是氧化劑,CO2是還原劑
B.1mol Na2O2參加反應,有2mole-轉移
C.Na2O2晶體中陰陽離子個數比為1:2
D.CO2分子中含有極性鍵和非極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在相同溫度下,有相同體積的甲、乙兩容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列敘述中錯誤的是
A. 化學反應速率:乙>甲 B. 平衡混合氣中H2的體積分數:乙>甲
C. H2的轉化率:乙>甲 D. 平衡后N2的濃度:乙>甲
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A是天然氣的主要成分,以A為原料在一定條件下可獲得有機物B、C、D、E、F,其相互轉化關系如圖。已知烴B在標準狀況下的密度為1.16 g·Lˉ1 , C能發生銀鏡反應,F為有濃郁香味,不易溶于水的油狀液體。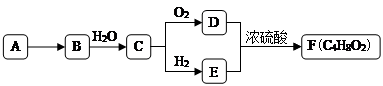
請回答:
① 有機物D中含有的官能團名稱是________。
②D+E→F的反應類型是________。
③有機物A在高溫下轉化為B的化學方程式是________。
④ 下列說法正確的是________。
A.有機物E與金屬鈉反應比水與金屬鈉反應要劇烈
B.有機物D、E、F可用飽和Na2CO3溶液鑒別
C.實驗室制備F時,濃硫酸主要起氧化作用
D.有機物C能被新制堿性氫氧化銅懸濁液、酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下VL氨氣溶解在1L水中(水的密度近似為1g/ml),所得溶液的密度為ρ g/ml,質量分數為w,物質濃度為cmol/L,則下列關系中不正確的是( )
A.ρ= ![]()
B.W= ![]()
C.W= ![]()
D.C= ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無機化合物可根據其組成和性質進行分類: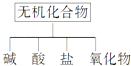
(1)如圖所示的物質分類方法名稱是 .
(2)以Na、K、H、O、C、S中任意兩種或三種元素組成合適的物質,分別填在表②③⑥的后面.
物質類別 | 酸 | 堿 | 鹽 | 氧化物 |
化學式 | ①HCl | ③ | ⑤Na2CO3 | ⑦CO2 |
(3)寫出⑦轉化為⑤的離子方程式: .
(4)實驗室制備⑦常用和反應(寫物質的化學式),檢驗該氣體的方法是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【加試題】ClO2是一種優良的消毒劑,濃度過高時易發生分解,常將其制成NaClO2固體,以便運輸和貯存。過氧化氫法制備NaClO2固體的實驗裝置如圖1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔點-59℃、沸點11℃;H2O2沸點150℃
請回答:
(1)儀器A的作用是;冰水浴冷卻的目的是(寫兩種)。
(2)空氣流速過快或過慢,均降低NaClO2產率,試解釋其原因。
(3)Clˉ存在時會催化ClO2的生成。反應開始時在三頸燒瓶中加入少量鹽酸,ClO2的生成速率大大提高,并產生微量氯氣。該過程可能經兩步反應完成,將其補充完整:①(用離子方程式表示),②H2O2+Cl2===2Clˉ+O2+2H+。
(4)H2O2濃度對反應速率有影響。通過圖2所示裝置將少量30% H2O2溶液濃縮至40%,B處應增加一個設備。該設備的作用是 , 餾出物是。
(5)抽濾法分離NaClO2過程中,下列操作不正確的是( )
A.為防止濾紙被腐蝕,用玻璃纖維代替濾紙進行抽濾
B.先轉移溶液至漏斗,待溶液快流盡時再轉移沉淀
C.洗滌沉淀時,應使洗滌劑快速通過沉淀
D.抽濾完畢,斷開水泵與吸濾瓶間的橡皮管后,關閉水龍頭
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.常溫下.NH4Cl溶液加水稀釋, ![]() 增大
增大
B.0.1mol/LNa2CO3溶液加熱后,溶液的pH減小
C.室溫下稀釋O.lmol/LCH3COOH溶液,溶液的導電能力減弱,因此溶液中所有離子濃度均減小
D.向沸水中滴加FeCl3飽和溶液制備Fe(OH)3膠體的原理是加熱促進Fe3+水解
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com