
【題目】苯胺(又名氨基苯)是最重要的胺類物質之一,可作為炸藥中的穩定劑、汽油中的防爆劑,也可作為醫藥磺胺藥的原料等。苯胺為無色油狀液體,有特殊氣味,可用水蒸氣蒸餾提純。用納米鐵粉還原硝基苯制備苯胺的原理及裝置圖(略去夾持裝置和加熱裝置)如下:
4![]() +9Fe+4H2O
+9Fe+4H2O![]() 4
4![]() +3Fe3O4
+3Fe3O4
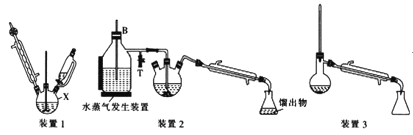
已知部分有機物的一些數據如下表:
名稱 | 密度(gmL-1) | 熔點(℃) | 沸點(℃) | 溶解性 | 備注 |
硝基苯 | 1.2037 | 5.7 | 210.8 | 難溶于水,易溶于乙醇、乙醚 | |
苯胺 | 1.0217 | -6.3 | 184.4 | 難溶于水,易溶于乙醇、乙醚 | 空氣中易變質 |
乙醚 | 0.7134 | -116.3 | 34.6 | 微溶于水,易溶于乙醇 |
Ⅰ.合成:在裝置1中的儀器X中,加入9g納米鐵粉、20mL水、1mL冰醋酸,加熱至煮沸,煮沸3~5min后冷卻至室溫,再將7.0mL硝基苯逐滴加入(該反應強烈放熱),攪拌、加熱、回流半小時,至反應完全。
Ⅱ.分離提純:將裝置1改為裝置2進行水蒸氣蒸餾,取裝置2中的餾出物約5~6mL,轉移至分液漏斗中,分離出有機層后,水層加入1.3gNaCl固體,用乙醚萃取3次(每次用7.0mL乙醚),合并有機層和乙醚萃取液,加入粒狀NaOH干燥,過濾后轉移至干燥的圓底燒瓶中,水浴蒸去乙醚,殘留物再利用裝置3蒸餾并收集溫度T℃時的餾分。
請回答下列問題:
(1)由苯制取硝基苯的化學方程式為__。
(2)儀器X的名稱是__;加入硝基苯時,“逐滴加入span>”的目的是__。
(3)分離提純過程中加入NaCl固體的作用是__。
(4)裝置2和裝置3都需要通冷凝水,冷凝水的作用是__;裝置2中長導管B的作用是__。
(5)萃取分液操作過程中要遠離明火和熱源,原因是__。
(6)溫度T的范圍為__,實驗結束得到6.0mL產物,則苯胺的產率為__(保留三位有效數字)。
【答案】![]() +HNO3
+HNO3![]() +H2O 三頸燒瓶(或三口燒瓶) 控制反應速率防止爆炸并提高硝基苯的轉化率 減小苯胺在水中的溶解度,提高苯胺的產率 冷凝蒸氣 起安全管的作用(或平衡裝置內外氣壓) 乙醚是易燃易揮發的物質 184.4210.8℃ 96.2%
+H2O 三頸燒瓶(或三口燒瓶) 控制反應速率防止爆炸并提高硝基苯的轉化率 減小苯胺在水中的溶解度,提高苯胺的產率 冷凝蒸氣 起安全管的作用(或平衡裝置內外氣壓) 乙醚是易燃易揮發的物質 184.4210.8℃ 96.2%
【解析】
裝置1中,硝基苯和Fe發生反應得到苯胺,步驟Ⅱ將得到的苯胺,與硝基苯等原料中分離出來,利用沸點的差異,首先采用蒸餾,得到硝基苯和苯胺的混合物,最后利用蒸餾的方法得到苯胺。
(1)在催化劑的作用下,苯環上的氫原子被硝基子所取代,生成硝基苯,同時有水生成:![]() ;
;
(2)儀器X是三頸燒瓶![]() 或三口燒瓶
或三口燒瓶![]() ;該反應強烈放熱,為了控制反應速率防止爆炸并提高硝基苯的轉化率,硝基苯逐滴加入;
;該反應強烈放熱,為了控制反應速率防止爆炸并提高硝基苯的轉化率,硝基苯逐滴加入;
(3)水中加入NaCl能降低苯胺的溶解,提高苯胺的產率;
(4)冷凝水的作用是冷凝蒸汽;裝置2中長導管B與外界相同,使得內外壓強相同,其作用是起安全管的作用![]() 或平衡裝置內外氣壓
或平衡裝置內外氣壓![]() ;
;
(5)乙醚是易燃易揮發的物質,萃取分液操作過程中要遠離明火和熱源;
(6)根據已知部分有機物的一些數據表,實驗目的是為了得到苯胺,而不是硝基苯,因此溫度T的范圍為![]() ;
;
根據題干的方程式可知,硝基苯和苯胺的物質的量相同,則理論產量為![]() ,而實際產量為
,而實際產量為![]()
則苯胺的產率為![]() 。
。


科目:高中化學 來源: 題型:
【題目】反應3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在溫度和容積不變的條件下進行。能表明反應達到平衡狀態的敘述是( )
Fe3O4(s)+4H2(g)在溫度和容積不變的條件下進行。能表明反應達到平衡狀態的敘述是( )
A. 容器內的總壓強不隨時間變化
B. 斷裂4molH—O鍵的同時,斷裂2molH—H鍵
C. 混合氣體分子的總數不變
D. 反應不再進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以氯酸鈉等為原料制備亞氯酸鈉的工藝流程如下,下列說法錯誤的是
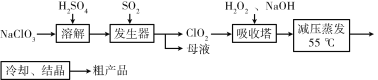
A. NaClO3在發生器中作氧化劑
B. 吸收塔中1mol H2O2得到2mol電子
C. 吸收塔中溫度不宜過高,會導致H2O2的分解
D. 從“母液”中可回收的主要物質是Na2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,濃度都是1 mol/L的兩種氣體X2和Y2,在密閉容器中反應生成氣體Z,經過t min后,測得各物質的濃度分別為c(X2)=0.4 mol/L,c(Y2)=0.6 mol/L,c(Z2)=0.4 mol/L,則該反應的化學方程式可表示為
A.2X2+3Y2![]() 2X2Y3B.3X2+2Y2
2X2Y3B.3X2+2Y2![]() 2X3Y2
2X3Y2
C.X2+2Y2![]() 2XY2D.2X2+Y2
2XY2D.2X2+Y2![]() 2X2Y
2X2Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種三室微生物燃料電池污水凈化系統原理如下圖所示,圖中含酚廢水中有機物可用C6H6O表示,左、中、右室間分別以離子交換膜分隔。下列說法不正確的是( )

A. 左池的pH值降低
B. 右邊為陰離子交換膜
C. 右池電極的反應式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 當消耗0.1molC6H6O,在標準狀況下將產生0.28mol氮氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X、Y、Z是三種原子序數依次增大的短周期元素。甲、乙、丙分別是三種元素形成的單質,A、B、C、D分別是由三種元素中的兩種形成的化合物,且A與C中均含有10 個電子。它們之間轉化關系如下圖所示。下列說法正確的是
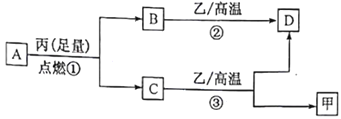
A. 原子半徑:Z>Y>X
B. X與Y形成的化合物只含極性鍵
C. Y有多種同素異形體,且均具有高熔點、高沸點、硬度大的性質
D. 氣態氫化物的穩定性:A<C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】普通鋅錳干電池的簡圖(下圖所示),它是用鋅皮制成的鋅筒作電極兼做容器,中央插一根碳棒,碳棒頂端加一銅帽。在石墨碳棒周圍填滿二氧化錳和炭黑的混合物,并用離子可以通過的長纖維紙包裹作隔膜,隔膜外是用氯化鋅、氯化銨和淀粉等調成糊狀作電解質溶液;該電池工作時的總反應為:Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O
關于鋅錳干電池的下列說法中正確的是
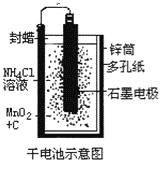
A.當該電池電壓逐漸下降后,利用電解原理能重新充電復原
B.電池負極的電極反應式為:2MnO2+2NH4++2e-= Mn2O3+2NH3+H2O
C.該電池碳棒可用銅棒代替,但是工作電壓會下降
D.外電路中每通過0.1 mol電子,鋅的質量理論上減小6.5g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016年12月1日國際純粹與應用化學聯合會宣布,將合成的四種新元素命名為113號 (縮寫為Nh)、115號(Mc)、117號(Ts)和118號(Og)。下列說法正確的是
A. 113號元素的氧化物為兩性氧化物
B. 115號元素位于第六周期第VA族
C. 117號元素的某種原子,核內含176個中子,此原子是![]() Ts
Ts
D. 118號元素的原子最外層有8個電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關金屬的工業制法中正確的是
A.制鈦:用金屬鈉在高溫下氧化TiCl4
B.煉鐵:用焦炭和空氣反應產生的CO在高溫下還原鐵礦石中鐵的氧化物
C.制鈉:用海水為原料制得精鹽,再電解純凈的NaCl溶液
D.制鎂:用海水為原料,經一系列過程制得氧化鎂固體,用氫氣還原氧化鎂得到鎂
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com