
實驗:① 向盛有1 mL 0.1 mol/L MgCl2溶液試管中加1 mL 0.2 mol/L NaOH溶液,得到濁液a,過濾得到濾液b和白色沉淀c。② 向沉淀c中滴加0.1mol/L FeCl3溶液,沉淀變為紅褐色。下列分析不正確的是
A.濁液a中存在沉淀溶解平衡:Mg (OH) 2(s) Mg2+(aq)+2OH-(aq) Mg2+(aq)+2OH-(aq) |
| B.濾液b中不含有Mg2+ |
| C.②中顏色變化說明Mg (OH)2轉化為Fe(OH)3 |
| D.實驗可以證明Fe(OH)3比Mg (OH)2更難溶 |
B
解析試題分析:① 向盛有1 mL 0.1 mol/L MgCl2溶液試管中加1 mL 0.2 mol/L NaOH溶液,恰好發生反應:MgCl2+2NaOH="Mg(OH)" 2↓+2NaCl。Mg(OH) 2在溶液中存在沉淀溶解平衡Mg (OH) 2(s) Mg2+(aq)+2OH-(aq)。所以得到濁液a中含有Mg(OH) 2、NaCl、、及Mg(OH) 2溶液,過濾得到濾液b中含有Mg2+、OH-、Na+、Cl-。和白色沉淀c Mg (OH) 2。② 向沉淀c中滴加0.1mol/L FeCl3溶液,由于在溶液中存在沉淀溶解平衡Mg (OH) 2(s)
Mg2+(aq)+2OH-(aq)。所以得到濁液a中含有Mg(OH) 2、NaCl、、及Mg(OH) 2溶液,過濾得到濾液b中含有Mg2+、OH-、Na+、Cl-。和白色沉淀c Mg (OH) 2。② 向沉淀c中滴加0.1mol/L FeCl3溶液,由于在溶液中存在沉淀溶解平衡Mg (OH) 2(s) Mg2+(aq)+2OH-(aq),Fe3++3OH-=Fe(OH)3↓。破壞了Mg(OH) 2的沉淀溶解平衡,使沉淀溶解平衡正向移動,結果白色沉淀逐漸溶解變為紅褐色沉淀,發生沉淀的轉化。因此錯誤的說法是B。
Mg2+(aq)+2OH-(aq),Fe3++3OH-=Fe(OH)3↓。破壞了Mg(OH) 2的沉淀溶解平衡,使沉淀溶解平衡正向移動,結果白色沉淀逐漸溶解變為紅褐色沉淀,發生沉淀的轉化。因此錯誤的說法是B。
考點:考查沉淀溶解平衡及沉淀轉化的知識。


科目:高中化學 來源: 題型:單選題
相同體積的pH=3的強酸溶液和弱酸溶液分別跟足量的鎂完全反應
| A.強酸溶液產生較多的氫氣 | B.兩者產生等量的氫氣 |
| C.無法比較兩者產生氫氣的量 | D.弱酸溶液產生較多的氫氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
氯化鈷溶液中存在下列平衡:CoCl42-(藍色) Co2+(粉紅色)+4Cl-,向氯化鈷稀溶液中加入一定量的濃鹽酸,溶液的顏色變化是
Co2+(粉紅色)+4Cl-,向氯化鈷稀溶液中加入一定量的濃鹽酸,溶液的顏色變化是
| A.由藍色變為粉紅色 | B.紅色加深 |
| C.由粉紅色變為藍色 | D.藍色加深 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
相同條件下,現有四種溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有關說法正確的是( )
| A.由水電離出的c(H+):①=②=③=④ |
| B.將②、③溶液混合后,pH=7,消耗溶液的體積:③>② |
| C.等體積的①、②、④溶液分別與足量鋁粉反應,②生成的H2的物質的量最大 |
| D.向溶液中加入100mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
牙齒表面覆蓋的牙釉質是人體中最堅硬的部分,起著保護牙齒的作用,其主要成分為羥基磷酸鈣[Ca5(PO4)3OH]。在牙齒表面存在著如下平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp = 6.8×10-37
5Ca2+(aq)+3PO43-(aq)+OH-(aq) Ksp = 6.8×10-37
下列說法錯誤的是( )
| A.殘留在牙齒上的糖發酵會產生H+,經常吃糖易造成齲齒 |
| B.由上述平衡可知,小孩長牙時要少吃糖多補鈣 |
| C.若減小OH-的濃度,上述平衡將向右移動,Ksp的值相應增大 |
| D.使用含氟牙膏能防止齲齒,是因為Ca5(PO4)3OH(s)轉化為更難溶的Ca5(PO4)3F(s) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
實驗:①0.1 mol·L-1 MgCl2溶液和0.2 mol·L-1NaOH溶液等體積混合得到濁液a,取少量濁液a過濾得到濾液b和白色沉淀c;②向濁液a中滴加0.1 mol·L-1FeCl3溶液,出現紅褐色沉淀。
下列分析不正確的是
| A.濾液b的pH=7 |
| B.②中顏色變化說明Mg(OH)2轉化為Fe(OH)3 |
| C.實驗可以證明Fe(OH)3的溶解度比Mg(OH)2的小 |
D.濁液a中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+ 2OH-(aq) Mg2+(aq)+ 2OH-(aq) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
有關電解質溶液的敘述,下列說法中正確的是
A.0.2 mol·L-1氨水中,c(OH-)與c(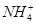 )相等 )相等 |
| B.10 mL 0.02 mol·L-1 HCl溶液與10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的體積為20 mL,則溶液的pH=12 |
| C.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| D.pH=3的一元酸和pH=11的一元堿等體積混和后的溶液中一定是c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
關于常溫下pH=2的醋酸溶液,下列敘述正確的是
| A.c(CH3COOH)=0.01mol·L-1 |
| B.c(H+)=c(CH3COO-) |
| C.加水稀釋100倍后,溶液pH=4 |
| D.醋酸的電離常數為Ka,CH3COO-的水解常數為Kh,則Ka·Kh=Kw |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關說法正確的是
| A.常溫下,0.1 mol/L NH4Cl溶液加蒸餾水稀釋,溶液的pH不斷增大,但無限接近7 |
| B.25 ℃時,溶液中水電離出的c(H+)和水電離出的c(OH-)的乘積一定等于10-14 |
| C.pH=6的純水中,c(OH-)=10-8 mol·L-1 |
| D.稀釋0.01 mol·L-1的醋酸溶液時,溶液中所有的離子濃度均減小 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com