
【題目】下列推論錯誤的是
A.NaCl為離子晶體,可推測CsCl也為離子晶體
B.CO2晶體是分子晶體,可推測CS2晶體也是分子晶體
C.NH4+為正四面體結構,可推測PH4+也為正四面體結構
D.NCl3中N原子是sp3雜化,可推測BCl3中B原子也是sp3雜化
【答案】D
【解析】
A.Cs和Na均為活潑金屬元素,與Cl形成離子鍵,所以NaCl、CsCl均是離子晶體,A正確;
B.CO2晶體由分子間作用力結合而成, CS2晶體也是由分子間作用力結合而成,都是分子晶體,B正確;
C.N、P為同主族元素,NH4+ 和PH4+中,中心N、P原子孤對電子數=![]() =0,σ鍵電子對數=
=0,σ鍵電子對數=![]() =4,價層電子對數=4+0=4,所以NH4+ 和PH4+中心原子皆為sp3雜化,空間構型均是正四面體,C正確;
=4,價層電子對數=4+0=4,所以NH4+ 和PH4+中心原子皆為sp3雜化,空間構型均是正四面體,C正確;
D.NCl3中N原子孤對電子數=![]() =1,σ鍵電子對數=
=1,σ鍵電子對數=![]() =3,價電子對數=3+1=4,所以NCl3中N原子是sp3雜化,BCl3中B原子孤對電子數=
=3,價電子對數=3+1=4,所以NCl3中N原子是sp3雜化,BCl3中B原子孤對電子數=![]() =0,σ鍵電子對數=
=0,σ鍵電子對數=![]() =3,價層電子對數=3+0=3,所以BCl3中B原子是sp2雜化,D錯誤。
=3,價層電子對數=3+0=3,所以BCl3中B原子是sp2雜化,D錯誤。
答案選D。


科目:高中化學 來源: 題型:
【題目】向1.00L濃度均為0.0100mol/L的Na2SO3、NaOH 混合溶液中通入HCl氣體調節溶液pH(忽略溶液體積變化)。其中比H2SO3、HSO3-、SO32-平衡時的分布系數(各含硫物種的濃度與含硫物種總濃度的比)隨HCl氣體體積(標況下)的變化關系如圖所示(忽略SO2氣體的逸出);已知Ka1代表H2SO3在該實驗條件下的一級電離常數。下列說法正確的是
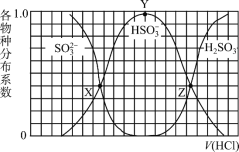
A.Z點處的pH=-lgKa1(H2SO3)
B.從X點到Y點發生的主要反應為SO32- +H2OHSO3- +OH-
C.當V(HCl)≥672mL時,c(HSO3-) = c(SO32-)=0mol/L
D.若將HCl改為NO2,Y點對應位置不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SiH4是一種無色的氣體,遇到空氣能發生爆炸性自燃,生成SiO2和液態H2O,已知室溫下2gSiH4自燃放出熱量89.2kJ,其熱化學方程式為:__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是A、B、C、D、E五種短周期元素的某些性質,下列判斷正確的是( )
元素 | A | B | C | D | E |
最低化合價 | -4 | -2 | -1 | -2 | -1 |
電負性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的簡單氫化物的穩定性:C>D>E
B.元素A的原子最外層中無自旋狀態相同的電子
C.元素B、C之間不可能形成化合物
D.與元素B同周期且在該周期中第一電離能最小的元素的單質能與![]() 發生置換反應
發生置換反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有X、Y、Z、Q、E、M、G原子序數依次增大的七種元素,除G元素外其余均為短周期主族元素。X元素原子中沒有成對電子,Y元素基態原子中電子占據三種能量不同的原子軌道且每種軌道中的電子數相同,Z元素原子的價電子排布式為![]() ,Q元素基態原子核外成對電子數足未成對電子數的 3倍,E與Q位于同周期,M元素的第一電離能在 同周期主族元素中排第三位,G元素原子的價電子 排布式為
,Q元素基態原子核外成對電子數足未成對電子數的 3倍,E與Q位于同周期,M元素的第一電離能在 同周期主族元素中排第三位,G元素原子的價電子 排布式為![]() 。回答下列問題:
。回答下列問題:
(1)寫出第3周期基態原子未成對電子數與G的相同且電負性最大的元素: ___________ (填元素名稱)。GQ受熱分解生成![]() 和
和![]() ,請從G的原子結構來說明
,請從G的原子結構來說明![]() 受熱易分解的原因: ______ 。
受熱易分解的原因: ______ 。
(2) Z、Q、M三種元素的第一電離能由大到小的順序為 _________ (用元素符號表示)。
(3) Y與Q形成原子個數比為1:2的化合物的電子式為 _________ 。
(4) Z、M、E所形成的簡單離子的半徑由大到小的順序為 __________ (用離子符號表示)。
(5) X、Y、Z、Q的電負性由大到小的順序為 _______ (用元素符號表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知C3N4晶體的硬度與金剛石相差不大,且原子間均以單鍵結合,下列關于C3N4的說法錯誤的是
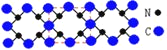
A.該晶體中碳原子和氮原子的最外層都滿足8電子穩定結構
B.C3N4晶體中C-N鍵的鍵長比金剛石的C-C鍵的鍵長要長
C.C3N4晶體中每個C原子連接4個N原子,每個N原子連接3個C原子
D.該晶體與金剛石相似,都是原子間以共價鍵形成的空間網狀結構
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I-具有還原性,含碘食鹽中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定條件下可發生如圖轉化關系,下列說法不正確的是

A.用淀粉-KI試紙和食醋可檢驗食鹽是否加碘
B.由圖可知氧化性的強弱順序為Cl2>IO3->I2
C.生產等量的碘,途徑I和途徑II轉移電子數目之比為5 :2
D.途徑III反應的離子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鈉(Na2FeO4)是具有紫色光澤的粉末,是一種高效綠色強氧化劑,堿性條件下穩定,可用于廢水和生活用水的處理。實驗室以石墨和鐵釘為電極,以不同濃度的NaOH溶液為電解質溶液,控制一定電壓電解制備高鐵酸鈉,電解裝置和現象如下:
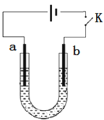
c(NaOH) | 陰極現象 | 陽極現象 |
1 mol·L-1 | 產生無色氣體 | 產生無色氣體,10min內溶液顏色無明顯變化 |
10 mol·L-1 | 產生大量無色氣體 | 產生大量無色氣體,3min后溶液變為淺紫紅色,隨后逐漸加深 |
15 mol·L-1 | 產生大量無色氣體 | 產生大量無色氣體,1min后溶液變為淺紫紅色,隨后逐漸加深 |
下列說法正確的是( )
A.a為石墨,b為鐵釘
B.陰極主要發生反應 4OH--4e-== O2↑+ 2H2O
C.高濃度的NaOH溶液,有利于發生Fe-6e-+ 8OH-== FeO42-+ 4H2O
D.制備Na2FeO4時,若用飽和NaCl溶液,可有效避免陽極產生氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】類比推理是化學中常用的思維方法。下列推理正確的是
A.lmol晶體硅含Si-Si鍵的數目為2NA,則1mol金剛砂含C-Si鍵的數目也為2NA
B.Ca(HCO3)2溶液中加入過量的NaOH溶液,發生化學反應的方程式:![]()
則Mg(HCO3)2溶液中加入過量的NaOH溶液,發生化學反應的方程式: ![]()
C.標準狀況下,22.4 L CO2中所含的分子數目為NA個,則22.4 LCS2中所含的分子數目也為NA個
D.NaClO溶液中通人過量CO2發生了反應:![]() ,則Ca(ClO)2溶液中通入過量CO2發生了:
,則Ca(ClO)2溶液中通入過量CO2發生了:![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com