
【題目】氯元素是中學化學中常見的重要非金屬元素之一,氯元素的單質及其化合物在生產與生活中有著重要的用途,依據所學知識完成下列問題:
Ⅰ.實驗室制備氯氣的化學方程式是_____________________;多余的氯氣用氫氧化鈉溶液吸收,其離子方程式為_________________
Ⅱ.常溫下,二氧化氯(ClO2)是一種黃綠色氣體,具有強氧化性,已被聯合國世界衛生組織(WHO)列為高效安全消毒劑。常溫下,它可用氯酸鈉固體與濃鹽酸反應制備得到,還有 NaCl與C12生成。
(1)寫出并配平該反應的化學方程式____________________。
(2)如果反應中生成標準狀況下11.2L 氯氣,則被氧化的 HCl的物質的量為_______,轉移電子數為_________。
(3)二氧化氯可迅速氧化硫化物(其中還原產物中氯元素為負一價),以除去水中硫化物產生的臭味。取適量ClO2,通入到含有H2S(二元弱酸)的水中,再向共中加入少量氯化鋇溶液,發現有白色沉淀生成。寫出ClO2與H2S水溶液反應的離子方程式____________。
【答案】MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O Cl2+2OH-=Cl-+ClO-+H2O 2NaClO3 + 4HCl(濃)= 2ClO2↑ + Cl2↑ + 2H2O + 2NaCl 1mol 6.02×1023或NA 5H2S + 8ClO2 + 4H2O = 5SO42- + 8Cl- + 18H+
MnCl2+Cl2↑+2H2O Cl2+2OH-=Cl-+ClO-+H2O 2NaClO3 + 4HCl(濃)= 2ClO2↑ + Cl2↑ + 2H2O + 2NaCl 1mol 6.02×1023或NA 5H2S + 8ClO2 + 4H2O = 5SO42- + 8Cl- + 18H+
【解析】
Ⅰ.(1)實驗室利用二氧化錳和濃鹽酸共熱制取氯氣;
Ⅱ.(1)氯酸鈉具有強氧化性,濃鹽酸具有還原性,氯酸鈉固體與濃鹽酸發生氧化還原反應生成二氧化氯、氯氣、氯化鈉和水;
(2)由方程式可得被氧化氯化氫、氯氣和轉移電子數目關系如下:2 HCl~Cl2↑~2e-,依據關系式計算即可;
(3)由題意可知,ClO2與H2S水溶液發生氧化還原反應生成鹽酸和硫酸。
Ⅰ.(1)實驗室制取氯氣的方程式為:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O;氫氧化鈉溶液吸收氯氣生成次氯酸鈉、氯化鈉和水,離子方程式為:Cl2+2OH-=Cl-+ClO-+H2O;故答案為:MnO2+4HCl(濃)
MnCl2+Cl2↑+2H2O;氫氧化鈉溶液吸收氯氣生成次氯酸鈉、氯化鈉和水,離子方程式為:Cl2+2OH-=Cl-+ClO-+H2O;故答案為:MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O;
MnCl2+Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O;
Ⅱ. (1)氯酸鈉具有強氧化性,濃鹽酸具有還原性,氯酸鈉固體與濃鹽酸發生氧化還原反應生成二氧化氯、氯氣、氯化鈉和水,反應的化學方程式為2NaClO3 +4HCl(濃)=2ClO2↑+Cl2↑+2H2O+2NaCl,故答案為:2NaClO3 +4HCl(濃)=2ClO2↑+Cl2↑+2H2O+2NaCl;
(2)由方程式可得被氧化氯化氫、氯氣和轉移電子數目關系如下:2 HCl~Cl2↑~2e-,標準狀況下,11.2L氯氣的物質的量為0.5mol,則被氧化的氯化氫和轉移電子的物質的量均為0.5mol×2=1mol,轉移的電子數目為6.02×1023或NA,故答案為:1mol;6.02×1023或NA;
(3)由題意可知,ClO2與H2S水溶液發生氧化還原反應生成鹽酸和硫酸,根據得失電子守恒、原子守恒和電荷守恒配平,反應的離子方程式為H2S+8ClO2 +4H2O=5SO42-+8Cl-+18H+,故答案為:H2S+8ClO2 +4H2O=5SO42-+8Cl-+18H+。


 應用題天天練四川大學出版社系列答案
應用題天天練四川大學出版社系列答案科目:高中化學 來源: 題型:
【題目】G是藥物合成的中間體,其部分合成路線如下:
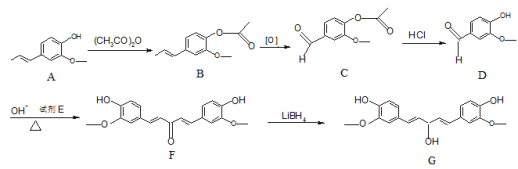
已知:RCHO + CH3COR1 ![]() RCH=CHCOR1 + H2O
RCH=CHCOR1 + H2O
請回答下列問題:
(1)C→D的反應類型為_______________。
(2)試劑E的名稱為_____________,G的分子式為_______________。
(3)寫出A→B的化學方程式__________________________________。
(4)設計A→B步驟的目的是__________________ 。
(5)芳香族化合物T是D的同分異構體,滿足下列條件的結構一共有___ 種。
①能發生銀鏡反應;
②遇FeCl3溶液不發生顯色反應,其在稀硫酸中的水解產物之一遇FeCl3溶液能發生顯色反應;
③在核磁共振氫譜上有七組峰;
(6)以環己醇和![]() 為原料,合成
為原料,合成 的路線為__________________________。
的路線為__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素W、X、Y、Z的原子序數依次增加,K、L、M均是由這些元素組成的二元化合物,甲、乙分別是元素X、Y的單質,甲是常見的固體,乙是常見的氣體。K是無色氣體,是主要的大氣污染物之一,0.05mol/L丙溶液的pH為l,上述物質的轉化關系如圖所示。下列說法正確的是
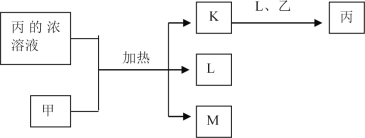
A. 原子半徑:W<X<Y B. 元素的非全屬性:Z>Y>X
C. 化合物XYZ中只含共價鍵 D. K、L、M中沸點最高的是M
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿伏伽德羅常數的值為NA,下列說法正確的是( )
A.在常溫常壓下, lmol 氦氣含有的原子數目為2NA
B.7. 1克氯氣通入足量的氫氧化鈉溶液中,轉移的電子數為0.2NA
C.標準狀況下,2.24L N2和O2的混合氣體中原子數為0.2NA
D.標準狀況下,2.24LHCl溶于500mL水中所得溶液濃度為2mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂-空氣電池是一種新型燃料電池,其工作原理如圖所示。下列說法錯誤的是( )
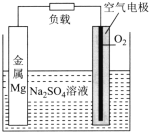
A.金屬Mg電極為負極,其電勢低于空氣電極的電勢
B.電子流向:Mg電極→導線→空氣電極→電解質溶液→Mg電極
C.電池總反應為2Mg+O2+2H2O=2Mg(OH)2
D.回收后的氫氧化鎂經一系列轉化,可重新制成鎂錠循環利用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生產、生活密切相關,下列敘述正確的是![]()
![]()
A.現用清潔燃料主要有壓縮天然氣和液化石油氣兩類,它們的主要成分均屬于碳氫化合物
B.為了防止月餅等富脂食品氧化變質,延長食品的保質期,常在其包裝中放入生石灰
C.煤經氣化和液化兩個物理過程后,可變為清潔能源,這是煤綜合利用的主要方法
D.棉花和木材的主要成分都是纖維素,蠶絲和人造絲的主要成分都是蛋白質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】不同條件下,用O2氧化a mol/L FeCl2溶液過程中所測的實驗數據如圖所示。下列分析或推測合理的是

A. 由①、②可知, pH越大,+2價鐵越易被氧化
B. 由②、③推測,若pH>7,+2價鐵更難被氧化
C. 由①、③推測,FeCl2被O2氧化的反應為放熱反應
D. 60℃、pH=2.5時, 4 h內Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CuCl廣泛應用于化工和印染等行業。某研究性學習小組擬熱分解CuCl2·2H2O制備CuCl,并進行相關探究。
(資料查閱)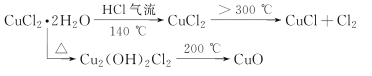
該小組用如圖所示裝置進行實驗(夾持儀器略)
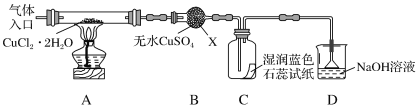
請回答下列問題:
(1)儀器X的名稱是___。
(2)實驗操作的先后順序是a→___→e(填操作的編號)。
a.檢查裝置的氣密性后加入藥品
b.熄滅酒精燈,冷卻
c.在“氣體入口”處通入干燥HCl
d.點燃酒精燈,加熱
e.停止通入HCl,然后通入N2
(3)在實驗過程中,觀察到B中物質由白色變為藍色,C中試紙的顏色變化是___。
(探究反思)
(4)反應結束后,取出CuCl產品進行實驗,發現其中含有少量的CuCl2或CuO雜質。根據資料信息
①若雜質是CuCl2,則產生的原因是___。
②若雜質是CuO,則產生的原因是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組同學探究物質的溶解度大小與沉淀轉化方向之間的關系。已知:
物質 | BaSO4 | BaCO3 | AgI | AgCl | |
溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(1)探究BaCO3和BaSO4之間的轉化
實驗操作:
試劑A | 試劑B | 試劑C | 加入鹽酸后的現象 | |
實驗Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
實驗Ⅱ | Na2SO4 | Na2CO3 | 有少量氣泡產生,沉淀部分溶解 |
① 實驗Ⅰ說明BaCO3全部轉化為BaSO4,依據的現象是加入鹽酸后,______。
② 實驗Ⅱ中加入稀鹽酸后發生反應的離子方程式是______。
③ 實驗Ⅱ說明沉淀發生了部分轉化,結合BaSO4的沉淀溶解平衡解釋原因:______。
(2)探究AgCl和AgI之間的轉化
實驗Ⅲ:
實驗Ⅳ:在試管中進行溶液間反應時,同學們無法觀察到AgI轉化為AgCl,于是又設計了如下實驗(電壓表讀數:a>c>b>0)。
裝置 | 步驟 | 電壓表讀數 | |
| ⅰ.如圖連接裝置并加入試劑,閉合K | a | |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | ||
ⅲ.再向B中投入一定量NaCl (s) | c | ||
ⅳ.重復ⅰ,再向B中加入與ⅲ等量NaCl(s) | a |
注:其他條件不變時,參與原電池反應的氧化劑(或還原劑)的氧化性(或還原性)越強,原電池的電壓越大;離子的氧化性(或還原性)強弱與其濃度有關。
① 實驗Ⅲ證明了AgCl轉化為AgI,甲溶液可以是______(填序號)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 實驗Ⅳ的步驟ⅰ中,B中石墨上的電極反應式是______。
③ 結合信息,解釋實驗Ⅳ中b<a的原因:______。
④ 實驗Ⅳ的現象能說明AgI轉化為AgCl,理由是______。
(3)綜合實驗Ⅰ~Ⅳ,可得出結論: ______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com