
【題目】某小組同學探究物質的溶解度大小與沉淀轉化方向之間的關系。已知:
物質 | BaSO4 | BaCO3 | AgI | AgCl | |
溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(1)探究BaCO3和BaSO4之間的轉化
實驗操作:
試劑A | 試劑B | 試劑C | 加入鹽酸后的現象 | |
實驗Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
實驗Ⅱ | Na2SO4 | Na2CO3 | 有少量氣泡產生,沉淀部分溶解 |
① 實驗Ⅰ說明BaCO3全部轉化為BaSO4,依據的現象是加入鹽酸后,______。
② 實驗Ⅱ中加入稀鹽酸后發生反應的離子方程式是______。
③ 實驗Ⅱ說明沉淀發生了部分轉化,結合BaSO4的沉淀溶解平衡解釋原因:______。
(2)探究AgCl和AgI之間的轉化
實驗Ⅲ:
實驗Ⅳ:在試管中進行溶液間反應時,同學們無法觀察到AgI轉化為AgCl,于是又設計了如下實驗(電壓表讀數:a>c>b>0)。
裝置 | 步驟 | 電壓表讀數 | |
| ⅰ.如圖連接裝置并加入試劑,閉合K | a | |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | ||
ⅲ.再向B中投入一定量NaCl (s) | c | ||
ⅳ.重復ⅰ,再向B中加入與ⅲ等量NaCl(s) | a |
注:其他條件不變時,參與原電池反應的氧化劑(或還原劑)的氧化性(或還原性)越強,原電池的電壓越大;離子的氧化性(或還原性)強弱與其濃度有關。
① 實驗Ⅲ證明了AgCl轉化為AgI,甲溶液可以是______(填序號)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 實驗Ⅳ的步驟ⅰ中,B中石墨上的電極反應式是______。
③ 結合信息,解釋實驗Ⅳ中b<a的原因:______。
④ 實驗Ⅳ的現象能說明AgI轉化為AgCl,理由是______。
(3)綜合實驗Ⅰ~Ⅳ,可得出結論: ______。
【答案】沉淀不溶解或無明顯現象 BaCO3 + 2H+ === Ba2+ + CO2↑+ H2O BaSO4在溶液中存在BaSO4(s) ![]() Ba2+(aq) + SO42-(aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動 b 2I- - 2e- === I2 由于生成AgI沉淀使B的溶液中c(I-)減小,I-還原性減弱 實驗ⅳ表明Cl-本身對該原電池電壓無影響,則c>b說明加入Cl-使c(I-)增大,證明發生了AgI + Cl-
Ba2+(aq) + SO42-(aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動 b 2I- - 2e- === I2 由于生成AgI沉淀使B的溶液中c(I-)減小,I-還原性減弱 實驗ⅳ表明Cl-本身對該原電池電壓無影響,則c>b說明加入Cl-使c(I-)增大,證明發生了AgI + Cl- ![]() AgCl + I- 溶解度小的沉淀容易轉化成溶解度更小的沉淀,反之則不易;溶解度差別越大,由溶解度小的沉淀轉化為溶解度較大的沉淀越難實現
AgCl + I- 溶解度小的沉淀容易轉化成溶解度更小的沉淀,反之則不易;溶解度差別越大,由溶解度小的沉淀轉化為溶解度較大的沉淀越難實現
【解析】
①因為BaCO3能溶于鹽酸,放出CO2氣體,BaSO4不溶于鹽酸,所以實驗Ⅰ說明全部轉化為BaSO4,依據的現象是加入鹽酸后,沉淀不溶解或無明顯現象。答案:沉淀不溶解或無明顯現象。
② 實驗Ⅱ是BaCl2中加入Na2SO4和Na2CO3產生BaSO4和BaCO3,再加入稀鹽酸有少量氣泡產生,沉淀部分溶解,是BaCO3和鹽酸發生反應產生此現象,所以反應的離子方程式為:BaCO3 + 2H+ = Ba2+ + CO2↑+ H2O。答案:BaCO3 + 2H+ = Ba2+ + CO2↑+ H2O。
③ 由實驗Ⅱ知A溶液為3滴0.1mol/LBaCl2,B為2mL0.1mol/L的Na2SO4溶液,根據Ba2++ SO42-= BaSO4![]() ,所以溶液中存在著BaSO4 (s)
,所以溶液中存在著BaSO4 (s) ![]() Ba2+(aq)+ SO42-(aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動。所以BaSO4沉淀也可以轉化為BaCO3沉淀。答案:BaSO4在溶液中存在BaSO4(s)
Ba2+(aq)+ SO42-(aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動。所以BaSO4沉淀也可以轉化為BaCO3沉淀。答案:BaSO4在溶液中存在BaSO4(s) ![]() Ba2+(aq)+ SO42-(aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動。
Ba2+(aq)+ SO42-(aq),當加入濃度較高的Na2CO3溶液,CO32-與Ba2+結合生成BaCO3沉淀,使上述平衡向右移動。
(2)①甲溶液可以是NaCl溶液,滴入少量的AgNO3溶液后產生白色沉淀,再滴入KI溶液有黃色沉淀產生。說明有AgCl轉化為AgI。故答案為:b。
② 實驗Ⅳ的步驟ⅰ中,B中為0.01mol/L的KI溶液,A中為0.1mol/L的AgNO3溶液,Ag+具有氧化性,作原電池的正極,I—具有還原性,作原電池的負極,所以B中石墨上的電極反應式是2I- - 2e- = I2。答案:2I- - 2e- = I2。
③ 由于AgI的溶解度小于AgCl,B中加入AgNO3溶液后,產生了AgI沉淀,使B的溶液中c(I-)減小,I-還原性減弱,根據已知其他條件不變時,參與原電池反應的氧化劑(或還原劑)的氧化性(或還原性)越強,原電池的電壓越大,而離子的濃度越大,離子的氧化性(或還原性)強。 所以實驗Ⅳ中b<a。答案:由于生成AgI沉淀使B的溶液中c(I-)減小,I-還原性減弱 。
④雖然AgI的溶解度小于AgCl,但實驗Ⅳ中加入了NaCl(s),原電池的電壓c>b,說明c(Cl-)的濃度增大,說明發生了AgI + Cl- ![]() AgCl + I-反應,平衡向右移動,c(I-)增大。答案:實驗ⅳ表明Cl-本身對該原電池電壓無影響,則c>b說明加入Cl-使c(I-)增大,證明發生了AgI + Cl-
AgCl + I-反應,平衡向右移動,c(I-)增大。答案:實驗ⅳ表明Cl-本身對該原電池電壓無影響,則c>b說明加入Cl-使c(I-)增大,證明發生了AgI + Cl- ![]() AgCl + I- 。
AgCl + I- 。
(3)綜合實驗Ⅰ~Ⅳ,可得出溶解度小的沉淀容易轉化成溶解度更小的沉淀,反之則不易;溶解度差別越大,由溶解度小的沉淀轉化為溶解度較大的沉淀越難實現。答案:溶解度小的沉淀容易轉化成溶解度更小的沉淀,反之則不易;溶解度差別越大,由溶解度小的沉淀轉化為溶解度較大的沉淀越難實現。


科目:高中化學 來源: 題型:
【題目】已知:pKa=lgKa,25℃時,H2SeO3 的 pKa1=1.34, pKa2=7.34。用 0.1molL1NaOH 溶 液滴定 20mL0.1molL1H2SeO3 溶液的滴定曲線如圖所示(曲線上的數字為 pH)。下列說法不正 確的是

A. a 點所得溶液中:2c(H2SeO3)+c(SeO32)<0.1 molL1
B. b 點所得溶液中:c(H2SeO3)+c(H+)=c(SeO32)+c(OH)
C. c 點所得溶液中:c(Na+)<3c(HSeO3)
D. d 點所得溶液中:c(Na+)>c(SeO3)>c(HSeO3 )
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對工業廢水和生活污水進行處理是防止水體污染、改善水質的主要措施之一。硫酸廠的酸性廢水中砷(As)元素(主要以H3AsO3形式存在)含量極高,為控制砷的排放,某工廠采用化學沉淀法處理含砷廢水。請回答以下問題:
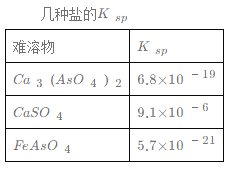
(1)若酸性廢水中Fe3+的濃度為1.0×10-4 mol·L-1,則c(AsO43-)不超過 ____mol·L-1。
(2)工廠排放出的酸性廢水中的三價砷(弱酸H3AsO3)不易沉降,可投入MnO2先將其氧化成五價砷 (弱酸H3AsO4),此時MnO2被還原為Mn2+,該反應的離子方程式為_________________。
(3)砷酸(H3AsO4)分步電離的平衡常數(25 ℃)為Ka1=5.6×10-3,Ka2=1.7×10-7,Ka3=4.0×10-12,第三步電離的平衡常數表達式為Ka3=_________,Na3AsO4第一步水解的離子方程式為AsO43-+H2O![]() HAsO42-+OH-,該步水解的平衡常數(25 ℃)為____。
HAsO42-+OH-,該步水解的平衡常數(25 ℃)為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ、化學實驗是化學學習的重要內容,根據你掌握的知識,完成下面內容。實驗室需要配制0.1mol·L-1 NaOH溶液230mL,請回答下列問題:
(1)用天平稱取______ g NaOH。配制過程中所需玻璃儀器除了膠頭滴管和燒杯,還有_____、______ 。
(2)溶解NaOH后的溶液需冷卻到室溫后方能轉移。若趁熱轉移會使溶液的濃度 _____(填“偏大”、或“偏小”,下同)
(3)有人認為,用這種方法只能配制0.1mol· L-1 的NaOH溶液,而無法得到0.1000mol· L-1 的NaOH溶液,你覺得他的理由是____________ 。
Ⅱ.氯氣是一種重要的化工原料,自來水消毒、農藥生產、藥物合成都需要它。

(1)工業上通常采用電解法制氯氣,請觀察圖1后回答下列問題:
通電后,b側產生的氣體用濕潤的淀粉碘化鉀試紙檢驗,現象是變藍。化學方程式_____
(2)某學生設計如圖2所示的實驗裝置,利用氯氣與潮濕的消石灰反應制取少量漂白粉(這是一個放熱反應),回答下列問題:
①在A裝置中制取氯氣,請寫出反應的化學方程式 ____________。
②漂白粉在U形管中產生,其化學方程式是 ____________。
③裝置C的作用是__________。
(3)此實驗所得漂白粉的有效成分偏低,該學生經分析并查閱資料發現,主要原因是在U形管中還存在兩個副反應:
①溫度較高時氯氣與消石灰反應生成Ca(ClO3)2,為避免此副反應發生,可采取的措施是_______。
②試判斷另一個副反應(用化學方程式表示)________,為避免此副反應的發生,可以在A與B之間連接一個裝有_______ 的洗氣瓶。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】檸檬酸(用HR 表示)是一種高效除垢劑,現用一定濃度的檸檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量隨pH的變化如圖所示。下列說法正確的是

A. H3R的第二步電離常數Ka2(H3R)的數量級為10-4
B. pH=6時,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于電離程度
D. pH=4時,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按如圖裝置進行實驗(a、b電極均為Cu電極),實驗開始觀察到靈敏電流計的指針發生偏轉。 下列有關說法正確的是

A. b極電極反應為Cu - 2e-=Cu2+B. 溶液中Cu2+穿過交換膜發生遷移
C. 電流計指針偏轉幅度將保持不變D. 外電路轉移的電子最多為0.02 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,HX溶液、HY溶液、HY和NaY的混合溶液,分別加水稀釋,稀釋后溶液的pH隨濃度的變化如圖所示,下列敘述正確的是

A. HX、HY均為一元強酸
B. 溶液中水的電離程度:a = b < c
C. 常溫下,HY的電離常數Ka約為1.0×10-4
D. c點溶液:c(Na+)>c(Y-)>c(HY) >c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)X原子在第二電子層上只有一個空軌道,則X是__;其軌道表示式為__;R原子的3p軌道上只有一個未成對電子,則R原子可能是__、 ;Y原子的核電荷數為29,其電子排布式是__,其在元素周期表中的位置是__,是屬于__區的元素。
(2)指出配合物K3[Co(CN)6]中的中心離子、配位體及其配位數:__、__、__。
(3)下列分子中若有手性原子,請用“*”標出其手性碳原子__。![]()
(4)在下列物質①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,屬于非極性分子的是(填序號)__。
(5)試比較下列含氧酸的酸性強弱(填“>”、“<”或“=”):H2SO4__H2SO3;H3PO4__H3PO3。
(6)根據價層電子對互斥理論判斷下列問題:
H2O中心原子的雜化方式為__雜化,分子的立體構型為__。
BF3分子中,中心原子的雜化方式為__雜化,分子的立體構型為__。
(7)H2O的沸點(100℃)比H2S的沸點(﹣61℃)高,這是由于________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
(一) 現代鋁的精煉研究方向是減低能耗。如圖 :室溫下通過電解在陰極沉積純鋁,A1Br3 在苯(簡寫 ArH)中可以生成[A12Br5ArH]+和 Br-。

(1)陽極的材料________;
(2)寫出陰極沉積鋁的電極方程式__________________________________________;
(二)鄰硝基苯甲酸是重要的醫院中間體,最新合成方法是鄰硝基甲苯和高錳酸鉀在相轉移催化劑季銨鹽(Q+X-)氧化、酸化合成,其原理如下:

相轉移催化原理如下:

有關物質的物理性質如下表:
物質 | 鄰硝基苯甲酸 | 高錳酸鉀 | 芐基三乙基氯化銨(C6H5-CH2CH2)N(C2H5)3Cl | 聚乙二醇 | 四丁基溴化銨(C4H9)4NBr | NH4Cl |
水 | 難溶 | 易溶 | 可溶 | 任意比互溶溶 | 可溶 | 易溶 |
有機物 | 易溶 | 難溶 | 易溶 | 易溶 | 易溶 | 難溶 |
下列說法不合理的是________;
A.相轉移催化劑作用主要決定于 Q+的物理化學性質
B.反應中為了防止溫度劇烈升高,投料應該分批加入
C.Q+X-是通過增大反應接觸面積提高反應速率
D.增大壓強可以提高鄰硝基甲苯氧化的反應限度
E.工業使用季銨鹽(Q+X-)可以提高鄰硝基苯甲酸產率
(2)四丁基溴化銨(C4H9)4NBr 萃取水中的高錳酸鉀的方程式為:KMnO4(aq) +Q+X-(aq) →Q+ MnO4- (aq) +KX(aq),寫出平衡常數 k 的表達式________________;設n(Q+X-):n(鄰硝基甲苯)=x,理論證明當 x=5%鄰硝基甲酸產率 y 得到最大值,請畫出 y 隨 x 變化的示意圖________________ 。
(3)實驗表明,當溫度 100℃、反應時間 2.5h,n(KMnO4): n(鄰硝基甲苯)=3:1,催化劑用量相同,Q+X-反應的催化效果如下:
相轉移催化劑 | 芐基三乙基氯化銨 (C6H5-CH2CH2) N(C2H5)3Cl | 聚乙二醇 | 四丁基溴化銨 (C4H9)4NBr |
產率% | 46.7 | 20.0 | 53.1 |
芐基三乙基氯化銨比四丁基溴化銨催化效果差的原因_____________________________;工業生產不用聚乙二醇做催化劑的主要原因____________________________________ ;
(4)(C4H9)4NBr 為催化劑,鄰硝基甲苯和高錳酸鉀反應,測得溶液酸堿性對產率、反應時間影響如圖 ,下列推測合理的是________。

A.溶液堿性強產率降低是因為季銨鹽發生水解反應
B.pH=2 高錳酸鉀一定發生副反應
C.選擇 pH=7、適當升溫可以提高產率
D.工業可以選擇濃硝酸替代高錳酸鉀做氧化劑,減緩對設備的腐蝕
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com