
【題目】下列說法正確的是
A.pH<7的溶液一定呈酸性
B.在純水中加入少量硫酸,可促進水的電離
C.雖然固體氯化鈉不能導電,但氯化鈉是電解質
D.Na2CO3溶液中,c(Na+)是c(CO32﹣)的兩倍
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A. 向MgCl2溶液中滴加過量氨水:Mg2++2OH-=Mg(OH)2↓
B. 用稀硝酸洗滌試管內壁的銀鏡:Ag+4H++NO![]() =Ag++NO↑+2H2O
=Ag++NO↑+2H2O
C. 將Cu粉加入到Fe2(SO4)3溶液中:2Fe3++3Cu=2Fe+3Cu2+
D. 向NaAlO2溶液中通入過量CO2:AlO![]() +CO2+2H2O=Al(OH)3↓+HCO
+CO2+2H2O=Al(OH)3↓+HCO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如表所示:
X | Y | Z | W | R | P | Q | |
原子半徑/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合價 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
其他 | 陽離子核外無電子 | 無機非金屬材料的主角 | 焰色反應呈黃色 |
(1)R在自然界中有質量數為35和37的兩種核素,它們之間的關系是互為________;
(2)Z的單質與水反應的化學方程式是____________________________;R與Q兩元素最高價氧化物水化物反應的離子方程式______________________________;
(3)Y與R相比,非金屬性較強的是___________(用元素符號表示),下列事實能證明這一結論的是________________(填字母序號);
a.常溫下Y的單質呈固態,R的單質呈氣態
b.穩定性XR>YX4
c.Y與R形成的化合物中Y呈正價
(4)寫出工業制取Y的單質的化學方程式__________________________;
(5)反應3X2(g)+P2(g)=2PX3(g)過程中的能量變化如圖所示,回答下列問題。

①該反應是______反應(填“吸熱”“放熱”);該反應的△H=_______________;
②反應體系中加入催化劑對反應熱是否有影響?__________(填“是”或“否”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硒(Se),是一種非金屬元素。可以用作光敏材料、電解錳行業催化劑、動物體必需的營養元素和植物有益的營養元素等。請回答下列問題:
(1) Se原子的核外電子排布式為____________。
(2) 比較As的第一電離能比Se______(填“大”或“小”)。
(3) SeO42-中Se-O的鍵角比SeO3的鍵角____(填“大”或“小”)原因是______________
(4) H2SeO4比H2SeO3水溶液的酸性___________。
(5) 硒單質是紅色或灰色粉末,帶灰色金屬光澤的準金屬,灰硒的晶體為六方晶胞結構,原子排列為無限螺旋鏈,分布在六方晶格上,同一條鏈內原子作用很強,相鄰鏈之間原子作用較弱,其螺旋鏈狀圖、晶胞結構圖和晶胞俯視圖如下。
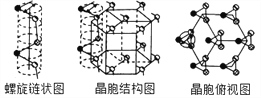
螺旋鏈中Se原子的雜化方式為__________。己知正六棱柱的邊長為acm,高為b cm,阿伏加德羅常數為NAmol-1,則該晶胞中含有的Se原子個數為_________,該晶體的密度為___________g/cm3 (用含NA、a、b的式子表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據原子結構及元素周期律的知識,下列推斷正確的是
A. 同主族元素含氧酸的酸性隨核電荷數的增加而減弱
B. 核外電子排布相同的微粒化學性質也相同
C. Cl-、S2、Ca2+、K+半徑逐漸減小
D. ![]() Cl與
Cl與![]() Cl得電子能力相同
Cl得電子能力相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】弱電解質的電離平衡、鹽類的水解平衡和難溶物的溶解平衡均屬于化學平衡。根據要求回答問題。
(1)生活中明礬常作凈水劑,其凈水的原理是_____________(用離子方程式表示)。
(2)常溫下,取0.2 mol/L HCl溶液與0.2mol/L MOH溶液等體積混合,測得混合后溶液的pH=5。寫出MOH的電離方程式:__________________。
(3)0.1mol/L的NaHA溶液,測得溶液顯堿性。則
① 該溶液中 c(H2A)_______________c(A2-)(填“>”、“<”或“=”)
② 作出上述判斷的依據是_____________(用文字解釋)。
(4)含Cr2O72-的廢水毒性較大,某工廠廢水中含5.0×10-3 mol/L的Cr2O72-。為了使廢水的排放達標,進行如下處理:
![]()
綠礬為FeSO4 7H2O。反應(I)中Cr2O72-與FeSO4的物質的量之比為___________。
常溫下若處理后的廢水中c(Cr3+)=6.0×10-7mol/L,則處理后的廢水的 pH=___________。
{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來全國各地長期被霧霾籠罩,霧霾顆粒中汽車尾氣占20%以上。已知汽車尾氣中的主要污染物為NOx、CO、超細顆粒(PM2.5)等有害物質。目前,已研究出了多種消除汽車尾氣污染的方法。根據下列示意圖回答有關問題:
(1)汽車發動機工作時會引發N2和O2反應,其能量變化示意圖如下:
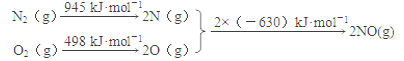
寫出該反應的熱化學方程式:_________________
(2)空燃比較易產生CO,有人提出可以設計反應2CO(g)===2C(s)+O2(g)來消除CO的污染。判斷該設想是否可行,并說出理由:_____________________。
(3)在汽車上安裝三元催化轉化器可實現反應:
(Ⅱ)2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH <0 。若該反應在恒壓的密閉容器中進行,則下列有關說法正確的是_______________
N2(g)+2CO2(g) ΔH <0 。若該反應在恒壓的密閉容器中進行,則下列有關說法正確的是_______________
A.其他條件不變,增大催化劑與反應物的接觸面積,能提高反應速率,使平衡常數增大
B.平衡時,其他條件不變,升高溫度,逆反應速率增大,正反應速率減小
C.在恒溫條件下,混合氣體的密度不變時,反應達到化學平衡狀態
D.平衡時,其他條件不變,增大NO的濃度,反應物的轉化率都增大
(4)將NO和CO以一定的流速通過兩種不同的催化劑進行反應(Ⅱ),經過相同時間內測量逸出氣體中NO的含量,從而確定尾氣脫氮率(脫氮率即NO的轉化率),結果如圖所示。以下說法正確的是__________。
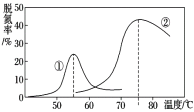
A.第②種催化劑比第①種催化劑脫氮率高
B.相同條件下,改變壓強對脫氮率沒有影響
C.在該題條件下,兩種催化劑分別適宜于55 ℃和75 ℃左右脫氮甲醇﹣空氣燃料電池(DMFC)是一種高效能、輕污染電動汽車的車載電池,其工作原理示意圖如圖甲,
該燃料電池的電池反應式為 2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)
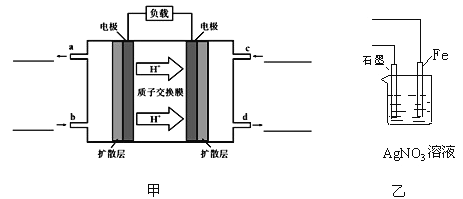
①負極的電極反應式為_______________,氧氣從_______________(填b或c)口通入
②用該原電池電解AgNO3溶液,若Fe電極增重5.4g,則燃料電池在理論上消耗的氧氣的體積為________mL(標準狀況)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上可由乙苯生產苯乙烯,反應原理如下:![]()
下列說法正確的是
A. 酸性高錳酸鉀溶液和溴水都可以用來鑒別乙苯和苯乙烯
B. 乙苯、苯乙烯均能發生取代反應、加聚反應,氧化反應
C. 乙苯的一氯取代產物有共有5種
D. 乙苯和苯乙烯分子內共平面的碳原子數最多均為7
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com