
【題目】甲、乙、丙三種物質的溶解度曲線如圖所示,根據圖中信息回答下列問題
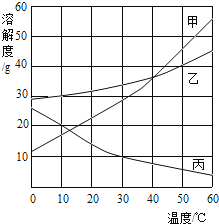
(1)50℃時,將40g乙物質放入50g水中充分溶解后,得到的溶液質量為_____g
(2)20℃時,甲、乙、丙三種物質溶解度由大到小的順序為_____
(3)請寫出一種符合丙曲線變化趨勢的物質_____(填俗名)
(4)50℃時,將等質量的甲、乙、丙三種物質的飽和溶液同時降溫至10℃,所得溶液中溶質質量分數最小的是_____。
(5)要配制110g溶質質量分數為9.1%的丙物質溶液,配制時溶液的溫度需要控制的范圍是_____。
【答案】70g 乙>甲>丙 熟石灰 丙 小于30℃
【解析】
(1)50℃時,乙物質的溶解度是40g,所以將40g乙物質放入50g水中充分溶解后,得到的溶液質量為70g;
(2)通過分析溶解度曲線可知,20℃時,甲、乙、丙三種物質溶解度由大到小的順序為:乙>甲>丙;
(3)丙物質曲線變化趨勢是隨溫度的升高而減小,所以該物質可以是:熟石灰;
(4)甲、乙物質的溶解度隨溫度的降低而減小,丙物質的溶解度隨溫度的升高而增大,10℃時甲、乙物質的溶解度大于50℃時丙物質的溶解度,所以50℃時,將等質量的甲、乙、丙三種物質的飽和溶液同時降溫至10℃,所得溶液中溶質質量分數最小的是丙;
(5)30℃時,丙物質的溶解度是10g,所以飽和溶液的質量分數為:![]() ×100%≈9.1%,要配制110g溶質質量分數為9.1%的丙物質溶液,配制時溶液的溫度需要控制的范圍是小于30℃。
×100%≈9.1%,要配制110g溶質質量分數為9.1%的丙物質溶液,配制時溶液的溫度需要控制的范圍是小于30℃。
故答案為:(1)70g;(2)乙>甲>丙;(3)熟石灰;(4)丙;(5)小于30℃。


科目:初中化學 來源: 題型:
【題目】模型是聯系宏觀與微觀的橋梁。
(1)如圖是鈉原子結構示意圖。
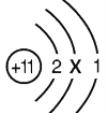
①X的數值為_________________。
②“11”指的是_________________。
③鈉原子在化學反應中易失去1個電子,形成_______(填離子符號)。
(2)下圖是氫分子和氧分子運動的示意圖。

①在A、B和C中,能比較得出“溫度越高,分子運動速率越快”的是__________(填標號)。
②從圖中可見,影響分子運動速率的因素除溫度外,還與______________________有關。
③舉一個能說明“溫度升高,分子運動速率加快”的生活事例:___________________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】2022年第24屆冬季奧林匹克運動會將在我國北京-張家口舉辦。
(1)下列冬奧會事項與化學無關的是_____________
A 研制新型材料用于場館建設 B 在短道速滑的冰道上灑水減少摩擦
C 用消毒劑處理奧運村生活污水 D 用清潔能源做汽車燃料接送運動員

(2)造雪機的工作原理如圖所示。A處空氣被壓縮,體積變小。從微粒的角度解釋其原因是__。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】興趣小組對粗鹽進行提純,并配制NaCl溶液。實驗流程如下圖:
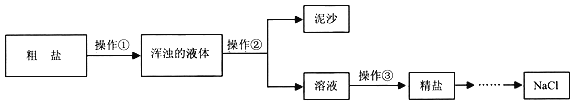
(1)操作③的名稱是_________。
(2)操作①②③都要用到的一種玻璃儀器是______,在操作②中,這種玻璃儀器的作用是_____
(3)計算精鹽的產率,結果偏低,可能的原因是______(寫一種)。
(4)配制100g6%的NaCl溶液,若實際配得的溶液溶質質量分數偏大,可能的原因是____(填標號)。
a 稱量NaCl所用天平砝碼已生銹 b 用量筒取水時俯視讀數
c 用量筒取水時仰視讀數 d 用殘留蒸餾水的燒杯配制溶液
(5)欲配制20g質量分數為3%的NaCl溶液,需要6%的NaCl溶液________mL(假設NaCl溶液的密度均為1.0g·cm-3)。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】圖表法是一種常用的數據處理方法,根據所給圖表(氫氧化鈉、碳酸鈉分別在水、酒精中的溶解度如表所示),下列說法正確的是( )
氫氧化鈉 | 碳酸鈉 | |||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 |

A. 上述圖象表示碳酸鈉的溶解度曲線
B. 20℃時,氫氧化鈉的溶解度大于碳酸鈉
C. 40℃時,若將 50g NaOH 分別投入到 100g 水和 100g 酒精中,都能形成飽和溶液
D. 40℃時,將適量 CO2 通入飽和的 NaOH 酒精溶液中,觀察不到明顯的現象
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】不少家庭養觀賞魚,有時會在魚缸里放點魚浮靈,可使水中的含氧量迅速增加,能有效提高魚的成活率,并且有殺菌作用。某小組對魚浮靈成份及原理進行了相關探究。
(實驗1)檢驗氣體
查閱資料1:魚浮靈化學名稱是過氧碳酸鈉(xNa2CO3yH2O2),常溫下,過氧碳酸鈉易溶于水并迅速放出氧氣。
實驗方案1::在一支試管中加入適量的魚浮靈,____________(將后續操作及現象補充完整),證明產生的氣體是氧氣。
(實驗2)檢驗反應后溶液中的溶質成分
猜想假設:猜想1:Na2CO3 猜想2:Na2CO3和NaOH
查閱資料2:用一定溶質質量分數的NaOH和Na2CO3兩種溶液進行如下實驗。
NaOH溶液 | Na2CO3溶液 | |
滴加酚酞溶液 | 現象 | 現象 |
加入稀鹽酸 | 無明顯現象 | 現象 |
加入澄清石灰水 | 無明顯現象 | 現象 |
加入 1%的CaCl2溶液 | 溶液變渾濁 | 溶液變渾濁 |
加入 0.1%的CaCl2溶液 | 無明顯現象 | 溶液變渾濁 |
表中的現象 _______(填序號)為溶液變紅色,現象③對應的化學反應方程式為____。
實驗方案 2:同學們取實驗 1 反應后的溶液于試管中,加入過量_____(填“1%”或“0.1%”)的 CaCl 2 溶液,充分反應后過濾,取少量濾液,向濾液中滴加無色酚酞溶液,觀察到濾液呈 _______色,證明猜想 1 正確。
(反思拓展) 根據上述探究可知,保存魚浮靈時應注意___________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖所示的四個圖象分別對應四種過程,其中正確的是( )
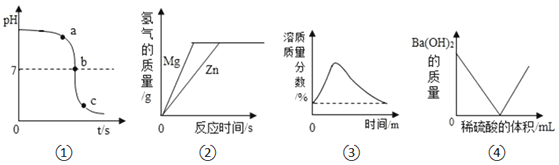
A. ![]() 將NaOH溶液逐滴滴加到盛有稀
將NaOH溶液逐滴滴加到盛有稀![]() 的燒杯中
的燒杯中
B. ![]() 分別向等質量且足量的Mg和Zn中加入等質量,等濃度的稀硫酸
分別向等質量且足量的Mg和Zn中加入等質量,等濃度的稀硫酸
C. ![]() 室溫時,向一定量的飽和石灰水中加入少量氧化鈣
室溫時,向一定量的飽和石灰水中加入少量氧化鈣
D. ![]() 向
向![]() 溶液中逐滴加入稀硫酸
溶液中逐滴加入稀硫酸
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】閱讀下面相關信息,根據要求回答問題:
鐵是目前世界上應用最廣泛的金屬,年產量位居第一。無論是日常生活用品,還是工農業生產或其他領域,都離不開鐵。實驗室中常用的還原鐵粉,灰色或黑色粉末,又稱“雙吸劑”,常用于食品保鮮。還原鐵粉一般由四氧化三鐵在高溫條件下,通入一氧化碳氣流還原生成,其主要成分為結構疏松的單質鐵,由于還原鐵粉本身已是粉末狀,再加之其微觀結構又十分疏松,所以其應用更加廣泛;另外,還原鐵粉在化工生產及實驗室作業中常用作優質還原劑。
(1)常見的鐵制品大多是生鐵或鋼、不銹鋼制成的,生鐵和鋼都是鐵的_____。
(2)鐵常被用來壓成薄片或拉成細絲,這主要利用了鐵的_____性。
(3)還原鐵粉常用于食品保鮮,主要是因為能夠吸收空氣中的_____。
(4)在實驗室中,用等質量的細鐵絲和還原鐵粉分別與等體積、等溶質質量分數的稀鹽酸反應,還原鐵粉與稀鹽酸的反應更劇烈,原因是_____。
(5)用四氧化三鐵制取還原鐵粉的化學方程式是_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在氫氧化鈉溶液和稀鹽酸的反應中,小明和老師用數字化設備測定了溶液溫度及pH值隨時間變化變化的關系曲線圖。
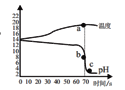
(1)根據曲線圖,可知該實驗是將_______(選填“氫氧化鈉溶液”或“稀鹽酸”)滴加到另外一種試劑中。該反應為___________。
A 吸熱反應 B 放熱反應
(2)a為溫度曲線上的最高點,a、b兩點對應的時間相同,則b對應的縱坐標數值為____。
(3)分別取樣,依次進行以下實驗:
①將b點處溶液中的溶質結晶,采用__________方法。
②取c點樣品于試管中,加足量水稀釋后溶液的pH__________7(填“>”、“<”或“=”)。
(4)若發現氫氧化鈉溶液試劑瓶敞口放置,經檢驗該試劑中含有碳酸鈉,請設計實驗檢驗該樣品中仍含有氫氧化鈉_______。
(5)將50g稀鹽酸加入50g氫氧化鈉溶液中恰好完全反應,所得溶液中溶質的質量分數為5.85%。試計算氫氧化鈉溶液中溶質的質量分數_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com