
題目列表(包括答案和解析)
| A.乙醇的電離方程式:2CH3CH2OH?CH3CH2OH2++CH3CH2O- |
| B.液氨的離子積常數為:1.0×10-28,則液氨濃度為1.0×10-14mol/L |
| C.若可用與pH相當的定義來規定pOH、pNH2-等,則乙醇中與pH相當的為-lgc(CH3CH2OH2+) |
| D.乙醇中KW=c(CH3CH2OH2+).c(CH3CH2O-)=1.0×10-30,則此時的p CH3CH2O-=-15 |
下表是幾種弱電解質的電離平衡常數、難溶電解質的溶度積Ksp(25℃)。
| 電解質 | 電離方程式 | 電離常數K | Ksp |
| H2CO3 | H2CO3 HCO3-+H+ HCO3-+H+HCO3-  CO32-+H+ CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| C6H5OH | C6H5OH C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | - |
| H3PO4 | H3PO4 H2PO4-+H+ H2PO4-+H+H2PO4-  HPO42-+H+ HPO42-+H+HPO42-  PO43-+H+ PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 | - |
| NH3·H2O | NH3·H2O OH-+NH4+ OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s) Ba2++SO42- Ba2++SO42- | - | 1.07×10-10 |
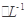 C6H5OH溶液中水的電離程度
C6H5OH溶液中水的電離程度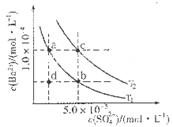
| 電解質 | 電離方程式 | 電離常數K | Ksp |
| H2CO3 | H2CO3 HCO3-+H+ HCO3-+H+HCO3-  CO32-+H+ CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| C6H5OH | C6H5OH C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | - |
| H3PO4 | H3PO4 H2PO4-+H+ H2PO4-+H+H2PO4-  HPO42-+H+ HPO42-+H+HPO42-  PO43-+H+ PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 | - |
| NH3·H2O | NH3·H2O OH-+NH4+ OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s) Ba2++SO42- Ba2++SO42- | - | 1.07×10-10 |
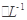 C6H5OH溶液中水的電離程度
C6H5OH溶液中水的電離程度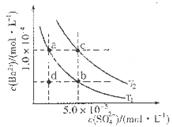
氮氣與氫氣反應生成氨氣的平衡常數見下表:
| | N2+3H2 2NH3 2NH3 | |||
| 溫度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常數K | 5×108 | 650 | 0.507 | 0.01 |
1.D 2.C 3.C 4.B 5.C 6.C 7.BC 8.BD 9.AC 10.D 11.C
12.BD 13.AC 14.A 15.B 16.D 17.B 18.D 19.B 20.D
21.D 22.C w.w.w.k.s.5.u.c.o.m
23.(1)促進,A (2)甲大
乙用氯化銨溶液稀釋后,[ ]增大很多,使
]增大很多,使 的電離平衡向抑制電離的方向移動;
的電離平衡向抑制電離的方向移動; 發生水解,使稀釋后的乙溶液的[
發生水解,使稀釋后的乙溶液的[ ]增大
]增大
24.(1)第一種組合 A:NaOH B:
第二種組合 A: B:
B:
(2)由于 電離出
電離出 ,使水的電離平衡:
,使水的電離平衡:

 向左移動,使水的電離度小于純水中水的電離度,而
向左移動,使水的電離度小于純水中水的電離度,而 溶液中由于
溶液中由于


由于 電離出的
電離出的 與
與 結合生成弱電解質
結合生成弱電解質 ,從而促進水的電離,使水的電離度比純水中的大.
,從而促進水的電離,使水的電離度比純水中的大.
25.(1)偏高;空氣中的氧氣溶于樣品中
(2)偏高;使 溶液濃度變低,消耗體積偏大
溶液濃度變低,消耗體積偏大
(3)偏高;使最后讀取體積數比實際消耗 溶液體積數大
溶液體積數大
(4)
26.(1)增大w.w.w.k.s.5.u.c.o.m
(2)K值越大,酸性越強
(3)

(4) 上一級電離產生的
上一級電離產生的 對下一級電離有抑制作用
對下一級電離有抑制作用
(5)
27.(1) 和
和 水解均呈弱酸性,可除去金屬表面的氧化物
水解均呈弱酸性,可除去金屬表面的氧化物
(2) 水溶液中[
水溶液中[ ]很小,不會生成沉淀(或弱酸不能生成強酸).加入氨水時,
]很小,不會生成沉淀(或弱酸不能生成強酸).加入氨水時,

 ,使
,使 電離平衡右移,[
電離平衡右移,[ ]增大,產生沉淀(或
]增大,產生沉淀(或 與
與 生成
生成 ,使[
,使[ ]增大
]增大
(3)在HCl氣流中, 抑制
抑制 水解,從而可得到
水解,從而可得到 無水物
無水物
(4)能. ,降低[
,降低[ ],其水解平衡左移,堿性減弱
],其水解平衡左移,堿性減弱
(5) 水解呈堿性,
水解呈堿性, 水解呈酸性,二者混合施用,會促進水解,大量生成易揮發的
水解呈酸性,二者混合施用,會促進水解,大量生成易揮發的 ,從而使氮肥降低肥效
,從而使氮肥降低肥效
 電離呈酸性,與
電離呈酸性,與 混合施用,會產生
混合施用,會產生 或
或 沉淀而喪失肥效.
沉淀而喪失肥效.
硫銨(即硫酸銨)水解呈酸性,長期施用土壤會板結酸化,加消石灰可調節酸度,防止板結.
28.(1)造成測定數值偏高w.w.w.k.s.5.u.c.o.m
(2)
(3)
29.(1) ;
; 、
、
(2)1.90 2.67 5.20
(3)130
分析:(1)因為在濁液中加入HCl溶液至10 mL,沉淀質量一直為 形式存在,繼續加入HCl溶液,
形式存在,繼續加入HCl溶液, 轉變為
轉變為 沉淀,加至30 mL時,
沉淀,加至30 mL時, 全部轉變為
全部轉變為 ,所以在A點的沉淀物為
,所以在A點的沉淀物為 ,在A至B點間,沉淀物為
,在A至B點間,沉淀物為 和
和 的混合物.當加入的HCl溶液超過30 mL時,
的混合物.當加入的HCl溶液超過30 mL時, 和
和 同時溶解.w.w.w.k.s.5.u.c.o.m
同時溶解.w.w.w.k.s.5.u.c.o.m
(2)原混合物中:
 的質量
的質量


 的質量
的質量
NaOH:
①濁液中存在的:
1×0.01 mol
② 消耗的:
消耗的:


③ 消耗的:
消耗的:

0.02 mol×4=0.08 mol
NaOH總質量
(3)從B點開始, 消耗的HCl:0.02 mol×3=0.06 mol
消耗的HCl:0.02 mol×3=0.06 mol
 消耗的HCl:0.02 mol×2=0.04 mol
消耗的HCl:0.02 mol×2=0.04 mol
所消耗HCl溶液的體積為:
Q點HCl溶液總量為:30 mL+100 mL=130 mL
30.(1)
(2)

根據 
過量 為:
為:
20.00 mL水樣消耗 為
為
根據得電子數目相等,則有
相當于 為:
為:
 ,即該水樣的
,即該水樣的
(3)
(4)A,
 www.ks5u.com
www.ks5u.com
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com