
第六單元 碳和碳的氧化物
課題1 金剛石、石墨和C60
教學目的;1:了解金剛石、石墨、C60的物理性質,并聯系性質了解它們的主要用途。通過單質的性質學習有關實驗,培養學生的觀察能力和思維能力。思想教育:通過對金剛石、石墨和C60的學習,對學生 進行共性、個性關系的認識人和學習方法的培養與教育。
2:使學生初步掌握碳的化學性質――穩定性、可燃性、還原性。進一步培養學生的觀察能力和思維能力。思想教育:通過碳與氧在不同條件下反應的產物不同,滲透物質所發生的化學反應既決定于物質本身的性質,又決定于反應條件的學習方法的指導。
重點: 金剛石、石墨和C60的重要物性和用途;金剛石和石墨物性差異很大的原因。碳的化學性質---穩定性、可燃性、還原性
難點:金剛石、石墨和C60的重要物性,碳的化學性質---穩定性、可燃性、還原性
教學過程:
[提問] 我們都見過晶瑩璀燦的金剛石,也經常使用鉛筆、碳棒,冬日里還可用木炭取暖,可你們知道它們各是由什么成份組成的?它們有什么聯系嗎?
[講解] 鉛筆芯、碳棒的主要成份是石墨,金剛石、石墨、木炭,還有活性炭、焦炭等都是由碳元素組成的不同單質。這節課主要學習金剛石、石墨及木炭的物理性質和用途。
[閱讀] 課本金剛石和石墨的物理性質。
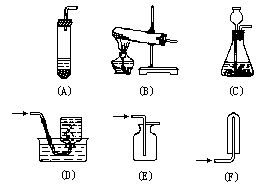
一、金剛石、石墨和C60的成份、物理性質及用途
1.利用金剛石硬度大、耐高溫可做鉆探機的鉆頭;利用硬度大,可做玻璃刀;由于金剛石對光有折射散射作用,可做裝飾品。
2.利用石墨質軟可做鉛筆芯;利用石墨滑膩、耐高溫,可做耐高溫的潤滑劑。
3.石墨可導電,可以做電極,又耐高溫可做高溫電爐的電極。
4.利用石墨傳熱性能好,并在溫度驟然升高時不易炸裂,可做石墨坩堝。
5.利用石墨耐酸堿的耐腐蝕性強,可做化工管道,耐酸槽、耐堿槽等。
[小結] 金剛石和石墨都是由碳元素組成的不同單質,性質上有如此大的差異是由于二者中碳原子的排列順序不同,即結構決定性質,性質決定用途。
[講解] 在碳元素組成的單質中,還有一類單質是無定形碳,包括木炭、焦炭、活性炭及炭黑等。(交待:“炭”與“碳”的不同寫法)
下面著重介紹木炭。
[演示] 1.將一個裝有半瓶帶淺紅色水的錐形瓶,配上膠塞。把兩塊木炭放入帶紅色的水中后,塞上塞子再搖動錐形瓶,注意觀察帶紅色的水中顏色的變化。
1、可燃性:提問:回憶木炭在氧氣中燃燒的實驗現象,并寫出相關的化學方程式
講述:木炭充分燃燒時生成二氧化碳(C + O2 點燃 CO2),如氧氣不足時,則會生成一氧化碳(2C+O2點燃2CO)
小結:碳和氫氣一樣,都具有可燃性,但在不同的條件下,其生成的產物不同
2:還原性演示實驗6-7(提醒學生注意觀察現象)
講解:現象是黑色固體變紅色,并有使澄清的石灰水變渾濁的氣體產生
板書:C+CuO高溫Cu+CO2
講解:①在該反應中,碳得到氧、被氧化生成二氧化碳,碳是還原劑。氧化銅失去氧、被還原成銅,是氧化劑 ②單質碳的還原性可用于冶煉金屬
焦炭可以把鐵從它們的氧化物中還原出來:2C+ Fe3O4 高溫 3Fe + 2CO2↑
3:一氧化碳和二氧化碳的相互轉化及熱量變化(討論)在燃燒的很旺的煤爐里,添上新煤后,溫度為什么會降低?且會有煤氣產生?講解:① 熾熱的碳還能使二氧化碳還原為一氧化碳 C+CO2點燃2CO(吸收熱量) ②C+O2點燃CO2 (放出熱量)
化學變化放出的熱量是一種重要的能源,可以供人取暖,也可以轉變其他能量。
“碳”是元素的名稱,是所有核電荷數為6的原子的總稱,元素符號為C。常在書寫碳元素的單質及含有碳元素的化合物名稱時使用。如碳元素、碳-60、一氧化碳、二氧化碳、碳酸、碳酸鈣、碳氫化合物等。“炭”僅在書寫由碳元素組成的無定形碳的名稱時使用,如木炭、活性炭、焦炭、炭黑等。
課題2 二氧化碳制取的研究
目的要求:1.使學生掌握實驗室制取二氧化碳的反應原理、實驗裝置和操作方法,提高學生分析和解決實際問題的能力。
2:學會實驗儀器的選擇。
重點:實驗室制取二氧化碳的反應原理、實驗裝置和操作方法
難點:從實驗室制取氣體的設計思路出發,研討實驗室制取二氧化碳氣體的方法。
教學過程:
在化學課程改革中倡導科學探究,要和化學學科的特點即實驗緊密結合起來。化學實驗是進行科學探究的重要方式,學生具備基本的化學實驗技能是學習化學和進行探究活動的基礎和保證。制取氣體實驗技能是初中化學實驗的重點和難點。根據《標準》,H2的制取實驗不要求了,初中的氣體制取實驗只有O2和CO2。O2的制取在第二單元中已介紹過,所以本單元安排課題2二氧化碳制取的研究,在學生已學過的O2的制取的基礎上,探究氣體的制備問題。CO2和H2的制取無論是從反應物的狀態,還是從反應條件等都有許多相似之處。由于H2的制取實驗不要求,所以完全讓學生探究CO2的制取是有困難的。因此,教材給出了實驗室中制取二氧化碳的化學反應原理、確定氣體發生裝置和收集裝置時應考慮的因素、CO2和O2制取實驗及相關性質比較,在此基礎上,給出了一些儀器,由學生自己來組裝制取二氧化碳的裝置,并利用裝置制取二氧化碳。因此,課題2重在讓學生掌握實驗室中制取氣體的思路和方法。
思考:寫出制取二氧化碳的反應式:C + O2 點燃 CO2
C+ 2CuO 高溫 2Cu + CO2↑ 2C+ Fe3O4 高溫 3Fe + 2CO2↑
問:實驗室制取氧氣的反應原理是什么?
[生答后總結]實驗室制取氧氣的原理是利用高錳酸鉀在加熱條件下得到氧氣或用過氧化氫(用二氧化錳做催化劑)制取氧氣。
當用固體反應,需要加熱產生氣體時,可采用高錳酸鉀在加熱條件下制取氧氣的裝置;當用固體與液體反應,不需加熱生成氣體時,可采用制取什么樣的的裝置。
一:實驗室制取二氧化碳的反應原理:常用大理石或石灰石和稀鹽酸制取。反應原理:碳酸鹽跟酸反應,生成二氧化碳。CaCO3+2HCl= CaCl2+H2O+CO2↑
(1) 石灰石跟稀鹽酸反應,現象:塊狀固體不斷溶解,產生大量氣泡。(石灰石跟稀硫酸反應,開始有氣體產生,過一會兒氣泡逐漸減少,以至反應停止。)
(2)碳酸鈉跟稀鹽酸反應十分劇烈,迅速產生大量氣體。石灰石跟稀鹽酸反應比碳酸鈉緩和,也能生成大量氣體。用硫酸代替鹽酸跟石灰石反應,雖能產生二氧化碳,但是生成的硫酸鈣微溶于水。它會覆蓋在塊狀石灰石表面,阻止碳酸鈣跟硫酸接觸。而碳酸鈉跟鹽酸反應太快,生成的二氧化碳不容易收集。因此,實驗室里通常是用石灰石跟稀鹽酸反應來制取二氧化碳的。
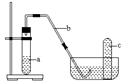
二:實驗室制取二氧化碳的裝置:〔討論〕
1.怎樣確定制取氣體的裝置?為什么可以用這樣的裝置制取二氧化碳?
2.為什么只采用向上排空氣法收集二氧化碳?
3.裝置中的長頸漏斗能否用普通漏斗代替?可用其他儀器代替錐形瓶嗎?
〔講解〕
1.實驗室制取氣體的裝置是根據所需藥品的狀態,反應條件來確定的。制取二氧化碳的反應物石灰石(或大理石)是固體,鹽酸是液體,反應是在常溫下進行的。反應前可以將固體置于錐形瓶中,液體在制取時從長頸漏斗中注入,液體與固體接觸時生成的氣體經導氣管導入集氣瓶中。
2.由于二氧化碳的密度大于空氣又能溶解于水,所以用這樣的裝置來收集二氧化碳。
3.為了避免產生的氣體從漏斗中逸出,必須使長頸漏斗的管口在液面以下,而普通漏斗頸太短不合適。錐形瓶在裝置中作為容器,可以用其他(如大試管、燒瓶、廣口瓶)口徑大小適宜的容器代替
 1:制二氧化碳可選用
收集氣體可選用
。
1:制二氧化碳可選用
收集氣體可選用
。
2:長頸漏斗為什么要插入液面?
3:這個裝置的氣體發生部分可以用來制取氫氣,因為制氫氣用的藥品狀態與制二氧化碳的相同,反應也不需要加熱。但收集方法不同,因為氫氣的密度小于空氣,又難溶于水 〔討論〕1.長頸漏斗可否用普通漏斗代替?
2.錐形瓶可否用別的儀器代替?
3.能否用濃鹽酸或稀硫酸代替稀鹽酸來制取二氧化碳?為什么?4.根據二氧化碳的性質,可以采用什么方法收集二氧化碳?5.如何檢驗二氧化碳是否收滿?
(講解)練1.不能用普通漏斗代替長頸漏斗,因為普通漏斗頸太短,產生的二氧化碳氣體會從漏斗處逸出。長頸漏斗下端管口必須在液面以下才能達到密封的效果。
2.錐形瓶可以用大試管、廣口瓶等玻璃儀器代替。
3.濃鹽酸具有較強的揮發性,使得收集到的二氧化碳氣體中含有氯化氫而不純。稀硫酸和碳酸鈣反應,發生如下反應:CaCO3+H2SO4=CaSO4+H2O+CO2↑
4.因為氣體的收集方法主要取決于氣體的密度及其在水中的溶解性。二氧化碳可溶于水并生成碳酸,故不宜用排水法收集。二氧化碳比空氣重,故可采用向上排氣法收集。
5.根據二氧化碳不能燃燒,不支持燃燒的性質,可以將燃著的木條放在集氣瓶口,如火焰熄滅,則二氧化碳已收滿。
實驗室制取氧氣、二氧化碳比較
氧氣
二氧化碳
反應原理
2KMnO4 加熱 K2MnO4 + MnO2 + O2↑
2H2O2
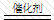 2H2O +O2↑
2H2O +O2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
發生
裝置
 A
B
C
A
B
C
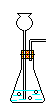
制取氧氣(用高錳酸鉀在加熱)可用A,用過氧化氫制取可用B,制CO2用C
收集方法
向上排空氣法、排水法
向上排空氣法
檢驗方法
用帶火星木條伸入集氣瓶中,若木條復燃該氣體是氧氣
將氣體通入澄清石灰水中,若石灰水變渾濁說明該氣體是CO2
課題3 二氧化碳和一氧化碳
教學目標:1.通過實驗分析,了解二氧化碳的物理性質,掌握二氧化碳的化學性質,根據它的性質解釋一些日常生活的問題。
2:掌握一氧化碳的可燃性和還原性,并了解它的用途。
3:初步培養學生對實驗裝置的評價、選擇和設計能力。
4:比較一氧化碳、氫氣和二氧化碳性質的異同點,引導學生掌握正確的學習方法和思維方
重點:1:二氧化碳的化學性質。
2:一氧化碳的可燃性和還原性
難點:1:二氧化碳與水和石灰水反應的原理。2:一氧化碳的可燃性和還原性
教學過程:
碳的化合物種類繁多,尤其是有機化合物在國民經濟的發展中起著非常重要的作用。而碳的氧化物(CO和CO2)不僅與學生的日常生活密切相關,同時也是初中化學元素化合物知識中非常重要的一部分:碳和碳的氧化物是以后學生學習許多化學反應的基礎,初中化學的許多反應都與碳和碳的氧化物有關。因此,本單元課題3介紹CO2和CO的性質和用途,為學生后續階段化學的學習打下堅實的基礎。
一:二氧化碳:
二氧化碳只占空氣總體積的0.3%,假如從空氣中除去這些二氧化碳,自然界的生命活動還能進行下去嗎?人和其他動物呼吸作用呼出的是什么氣體?植物進行光合作用消耗的又是什么氣體?若沒有這種氣體,自然界的生命活動還能進行下去嗎?
幾個關于二氧化碳性質的實驗:
實驗
現象
原因或反應式
傾倒CO2
實驗6-13
燒杯底下的蠟燭先熄滅
CO2的密度比空氣大。不能燃燒,也不支持燃燒。
CO2 溶解性實驗
實驗6-14
塑料瓶子會變形
CO2能溶于水,壓強減少
CO2與水反應實驗
實驗6-15
紫色石蕊的花會變紅,加熱后又變紫色
H2O + CO2= H2CO3
H2CO3 == H2O + CO2↑
二氧化碳與水的反應比較抽象,是課題3教學難點之一。舊教材中的實驗,學生往往認為是二氧化碳使石蕊變成紅色。
為突破這個教學難點,這個實驗設計為五步:(Ⅰ) 向干燥的紫色石蕊小花(紙花)噴稀醋酸;(Ⅱ) 向干燥的紫色石蕊小花噴水;(Ⅲ) 直接把干燥的紫色石蕊小花放入二氧化碳中;(Ⅳ) 將干燥的紫色石蕊小花噴水后放入二氧化碳中;(Ⅴ) 將(Ⅳ)中的小花取出后小心加熱。(Ⅰ) 、(Ⅱ)、(Ⅲ)是獨立的,是為(Ⅳ)作鋪墊的,目的是使學生認識到是二氧化碳與水反應生成的碳酸使紫色石蕊變成紅色,(Ⅴ) 是說明碳酸的不穩定性。通過觀察實驗現象,可以得出以下結論:
(1) 石蕊是一種色素,遇酸變成紅色。
(2) 水不能使紫色石蕊變成紅色,二氧化碳也不能使紫色石蕊變成紅色。
(3) 二氧化碳與水反應生成碳酸,碳酸能使紫色石蕊變成紅色。
(4) 碳酸不穩定,容易分解成二氧化碳和水。
該實驗除教材中的設計以外,還可作如下改進:
(Ⅰ) 把干燥的紫色石蕊小花放入二氧化碳中;(Ⅱ) 將(Ⅰ)中的小花噴水,觀察,然后將其放入二氧化碳中;(Ⅲ) 向干燥的紫色石蕊小花(紙花)噴稀醋酸; (Ⅳ) 將(II)中的小花取出后小心加熱。
二氧化碳的化學性質:
1:一般情況下,二氧化碳不能燃燒,也不支持燃燒不供給呼吸。
2:二氧化碳跟水反應生成碳酸,碳酸能使紫色石蕊試液變紅色。
CO2+H2O=H2CO3(紫變紅)
碳酸不穩定,很容易分解成水和二氧化碳,所以紅色石蕊試液又變成紫色, H2CO3==H2O+CO2↑ (紅變紫) 3:二氧化碳跟石灰水反應:CO2+Ca(OH)2==CaCO3↓+H2O (清變濁)
二氧化碳的用途:二氧化碳不支持燃燒,不能燃燒,且比空氣重,可用它來滅火。(簡介滅火器原理),干冰升華時吸收大量熱,可用它做致冷劑或用于人工降雨。工業制純堿和尿素,植物光合作用。綠色植物吸收太陽能,同化二氧化碳和水,合成有機物質并釋放出氧的過程,叫做光合作用。總反應式可表示為:
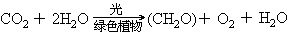 6(CH2O)→C6H12O6(葡萄糖)由葡萄糖出發,還能進一步合成脂肪、氨基酸及蛋白質等。光合作用是地球上利用太陽能最重要的過程,也是規模最大的由二氧化碳和水等無機物制造碳水化合物、蛋白質、脂肪等有機物的過程。光合作用包括光反應(光所誘發的化學反應)和暗反應(若干酶所催化的化學反應)兩大部分。根據現有資料,認為光合作用大致按下列四個過程進行:
6(CH2O)→C6H12O6(葡萄糖)由葡萄糖出發,還能進一步合成脂肪、氨基酸及蛋白質等。光合作用是地球上利用太陽能最重要的過程,也是規模最大的由二氧化碳和水等無機物制造碳水化合物、蛋白質、脂肪等有機物的過程。光合作用包括光反應(光所誘發的化學反應)和暗反應(若干酶所催化的化學反應)兩大部分。根據現有資料,認為光合作用大致按下列四個過程進行:
一般條件下,二氧化碳不支持燃燒且比空氣重,將二氧化碳覆蓋在燃著的物體表面,可使物體跟空氣隔絕而停止燃燒,因此二氧化碳可用滅火,是常用的滅火劑。在化學工業上,二氧化碳是一種重要的原料,大量用于生產純堿(Na2CO3)、小蘇打(NaHCO3)、尿素[CO(NH2)2]、碳酸氫銨(NH4HCO3)、顏料鉛白[Pb(OH)2?2PbCO3]等。在輕工業上,生產碳酸飲料、啤酒、汽水等都需要二氧化碳。在現代化倉庫里常充入二氧化碳,防止糧食蟲蛀和蔬菜腐爛,延長保存期。固態的二氧化碳即“干冰”,主要用作致冷劑,用飛機在高空噴撒“干冰”,可以使空氣中水蒸氣冷凝,形成人工降雨;在實驗室里,“干冰”與乙醚等易揮發液體混合,可以提供-77℃C左右的低溫浴。“干冰”還可以做食品速凍保鮮劑。在農業上,溫室里直接施用二氧化碳作肥料,利用植物根部吸收二氧化碳,可以增進植物的光合作用。促進農作物生長,增加產量。在自然界,二氧化碳保證了綠色植物進行光合作用和海洋中浮游植物呼吸的需要。
貯藏糧食、水果、蔬菜。用二氧化碳貯藏的食品由于缺氧和二氧化碳本身的抑制作用,可有效地防止食品中細菌、霉菌、蟲子生長,避免變質和有害健康的過氧化物產生,并能保鮮和維持食品原有的風味和營養成分。二氧化碳不會造成谷物中藥物殘留和大氣污染。用二氧化碳通入大米倉庫24h,能使99%的蟲子死亡。
作為萃取劑。國外普遍利用二氧化碳進行食品、飲料。油料、香料、藥物等加工萃取。
用二氧化碳與氫氣做原料,可生產甲醇、甲烷、甲醚、聚碳酸酯等化工原料和新燃料。
作為油田注入劑。可有效地驅油和提高石油的采油率。
注入地下難于開采的煤層,使煤層氣化,獲得化工所需的合成氣體和居間物。
保護電弧焊接,既可避免金屬表而氧化,又可使焊接速度提高大約9倍。
有的科學家認為,大氣中二氧化碳加倍,將使糧食平均增產超過30%,棉花增長80%以上,小麥和水稻一類作物增產36%。
在烹飪中用發酵粉或蘇打的日的是為付了產生微小的二氧化碳氣泡。這些氣泡使面包、糕點或發面膨脹,吃起來松軟適口。在制造面包時使用酵母,其作用與此相同,只是時間長些而已。發酵粉(或碳酸氫鈉)與一種酸(如從酸牛奶產生的乳酸)作用而產生二氧化碳。市售“發酵粉”中常含有固態酸,在潮濕時,它與碳酸氫鈉發生作用,也產生二氧化碳。 溫室效應的危害性后果是:1.冰川融化和海平面上升。事實上,冰川融化已經開始,發展下去,海面將升高,一些沿海城市將被海水淹沒;2.頻繁、嚴重的旱災;3.更多更利害的塵暴;4.更頻繁更厲害的颶風;5.更頻繁更嚴重的森林火災;6.野生動物瀕臨滅絕。
具有溫室效應的氣體不只是二氧化碳,還有甲烷、氟里昂等氣體。
1.溫室效應試驗
實驗步驟:取兩只250ml的錐形瓶。一只裝滿制得的二氧化碳氣體,另一只內是空氣。用連有溫度計的單孔橡皮塞塞住瓶口,把它們彼此靠近地置于實驗桌上,錐形瓶底部放置一塊面積大于兩個錐形瓶瓶底面積的黑色的木板或紙板。在錐形瓶上方用功率為100w的反射燈泡均勻地照射,觀察瓶內溫度升高的情況。
溫度
開始
1分鐘
2分鐘
3分鐘
5分鐘
空氣
二氧化碳
實驗結論:
人工降雨 1932年諾貝爾化學獎的得主、美國化學家兼物理學家蘭茂爾,一生進行過有益的研究,但他在科學上實現的最大突破還是人工降雨。在獲得諾貝爾獎后,他就和化學家射弗等人共同進行了人工降雨的研究。在他的研究室里保存著小小的人工云,它就是充斥在電冰箱里的水蒸氣。蘭茂爾一邊降低冰箱里的溫度,一邊加入各種塵埃微粒進行降雨實驗。1946年7月 的一天,天氣異常炎熱,由于實驗裝置出了故障,裝有人工云的電冰箱里的溫度一直降不下來,蘭茂爾只好臨時用固態二氧化碳(干冰)來降溫。當他則把一塊干冰放進冰箱里,這時奇跡出現了:水蒸氣立即變成了許多小冰粒,在冰箱里盤旋飛舞,人工云化為了霏霏飄雪。這一奇特現象使他明白塵埃微粒對降雨并非絕對必要,只要將溫度降到零下40度以下,水蒸汽就會變成冰而降落下來。蘭茂爾高興地去找射弗,商量怎樣把這一想法付諸現實。接著便出現了振奮人心的一幕:1946年的一天,一架飛機在云海上飛行,蘭茂爾和射弗將干冰撒播在云層里,30分鐘后就開始了降雨。第一次真正的人工降雨獲得了成功。后來,美國通用電氣公司的本加特又對蘭茂爾的人工降雨方法進行了改良,他用碘化銀微粒取代干冰,使人工降雨更加簡便易行。蘭茂爾在1957年去世時,終于滿意地看到人工降雨已發展成為一項大規模的事業。人工降雨的發明,標志著氣象科學發展到了一個新的水平,但遺憾的是,它也曾被用于非正義的戰爭。如1967~1972年,美國在侵越戰爭中出動了2600架次飛機進行人工降雨,目的在于截斷"胡志明小道"運輸線,結果造成山洪暴發,交通堵塞,其破壞效果超過了常規轟炸。當然,美國政府這種濫用人工降雨的行徑受到了世界輿論的譴責。
為了保護臭氧層,人類簽訂了以減少并逐步停止生產和使用氟氯代烷為目標的《保護臭氧層維也納公約》、《關于消耗臭氧層物質的蒙特利爾議定書》等國際公約
氟氯代烷:氟氯代烷就是人們熟悉的“氟利昂”,氟利昂是英文“Freon”的音譯。由于“Freon”是現今仍保留專利注冊的外國商品名,所以“氟利昂”在教材中不宜使用。氟利昂實際是一類多鹵代烴,主要是含氟和氯的烷烴衍生物,其中最常用的是一氟三氯甲烷(CCl3F,商品名叫氟利昂-11)和二氟二氯甲烷(CCl2F2,商品名叫氟利昂-12)等。因此教材中把氟利昂改稱為學名――氟氯代烷。
需要注意的是,破壞臭氧層是氟氯代烷中的氯,而不是氟。氟氯代烷的化學性質很穩定,它進入大氣后隨氣流上升,在平流層中受紫外線的照射,發生分解產生氯原子,氯原子可引發損耗臭氧的反應。
氯原子破壞臭氧層的反應為:Cl+O3=ClO+O2 ClO+O=Cl+O2 總反應為:O+O3=2O2
在反應中,Cl原子并沒有消耗,而臭氧分子變成了氧氣分子,Cl原子在其中起了催化劑的作用,每個Cl原子能參與大量的破壞臭氧分子的反應。因此,即使逸入平流層中的氟氯代烷不多,但由它們分解出來的Cl原子可長久地起著破壞臭氧的作用。
二:一氧化碳
【引言】碳元素有+2和+4價,所以碳的氧化物有一氧化碳和二氧化碳兩種。前面我們已經學過二氧化碳的性質和制法,今天開始學習有關一氧化碳的知識。
【板書】一氧化碳
師:我們先學習一氧化碳的物理性質。
【板書】1:一氧化碳的物理性質
師:同學們一定聽說過煤氣中毒的事例,煤氣中毒實際就是指一氧化碳中毒。它有沒有顏色?有沒有氣味?能否溶于水?
生:沒有顏色,但有氣味,不清楚是否溶于水。
【展示】盛滿一氧化碳氣體的集氣瓶。(觀察氣體的顏色和狀態。)
生:一氧化碳是無色氣體。
【演示】操作:(1)把兩支分別盛滿一氧化碳和二氧化碳的試管倒置在水槽中,用投影儀演示,讓學生觀察水面是否上升。(2)用拇指按住盛一氧化碳的試管口,從水槽中取出試管,松開手指讓一位學生聞氣體氣味(提示用正確的操作方法聞氣味),(3)按(2)同樣操作從水槽中取出另一試管,滴入2滴~3滴石蕊試液。
【講述】把兩支盛滿氣體的試管倒置在水槽中。如果氣體能溶于水,試管內的氣壓減小,大氣壓會把水壓入管內,引起液面上升。如果氣體不溶于水,液面不會有變化。你們通過實驗得出什么結論?
生甲:一氧化碳不溶于水,無氣味。二氧化碳能溶于水。
生乙:二氧化碳溶于水后,跟水反應生成碳酸,使石蕊試液變紅。
師:由此說明,平時聞到的煤氣味并不是一氧化碳的氣味。下面請大家填寫下表。
顏色
氣味
狀態
溶解性
密廢(與空氣比)
CO
CO2
H2
(氣體的密度跟空氣的比較可以通過比較氣體的相對分子質量和空氣的平均相對分子質量29得到。)
師:根據一氧化碳的物理性質,我們在實驗室應怎樣收集它呢?
生:排水集氣法或向下排氣法。
師:用向下排氣法行不行?不行,因為一氧化碳無色,無法知道氣體是否集滿,而且一氧化碳有毒,長時間收集會使實驗者中毒。
【板書】2:一氧化碳的毒性和對空氣的污染
【講述】之所以引起煤氣中毒,是因為一氧化碳被人吸進肺中,跟血液里血紅蛋白結合。一氧化碳跟血紅蛋白的結合能力比氧氣大200倍~300倍,造成機體急性缺氧。當一氧化碳在空氣中濃度為0.02%時,人在2 h~3h后就會出現頭暈惡心的癥狀;濃度達0.08%時,2h即昏迷;濃度再高,將危及生命。
【提問】用化學方程式表示生成CO的兩種途徑。在什么情況下容易發生一氧化碳中毒?
生:2C+O2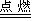 2CO, CO2十C
2CO, CO2十C 2CO
2CO
學生討論,教師小結:(1)火爐通風不良,氧氣供給不足。(2)當爐火快熄滅或剛加煤時,火爐里中下層煤炭燃燒產生的二氧化碳向上通過灼熱煤炭會產生較多一氧化碳。因此,我們不宜長時間在密閉房間里使用炭火取暖。
師:有人用爐火取暖,為了防止發生煤氣中毒,在火爐上放一盆水,這樣做行嗎?為什么?
生:不行,因為一氧化碳難溶于水。
師:有人說只要一聞到煤氣味就把火爐搬出去,就不會造成煤氣中毒這種說法對嗎?為什么?
生:不對,因為一氧化碳沒有氣味。
【講述】煤氣中毒的預防措施和急救措施。

【板書】3:一氧化碳的化學性質
(1).可燃性
師:用煤爐燒水時,水開時常會溢出來,灑在通紅的煤上,會發生什么現象? 生:會聽到“?”的聲響,同時火苗竄得很高。師:對。這是因為發生下列反應: C+H2O CO+H2,產生的一氧化碳和氫氣都能燃燒,發出藍色火焰。
CO+H2,產生的一氧化碳和氫氣都能燃燒,發出藍色火焰。
【板書】2CO+O2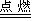 2CO2
2CO2
師:在實驗中看到什么現象?
生:一氧化碳能燃燒,發出藍色火焰,放出大量的熱。
生:生成氣體能使澄清的石灰水變渾濁。
師:應該怎樣鑒別一氧化碳和氫氣?
生:把干冷潔凈的燒杯分別罩在兩種點燃氣體的火焰上方,燒杯上有水珠的原氣體是氫氣,另一瓶是一氧化碳。
生:也可將沾有石灰水的燒杯分別罩在兩種點燃氣體的火焰上方,燒杯上有白色斑痕的原氣體是一氧化碳,另一瓶是氫氣。
[評注:認識一氧化碳的可燃性,既能聯系生活實際,又能從跟氫氣的可燃性和燃燒產物作比較中學活新知識,使舊知識得到復習、鞏固、深化。]
【小結】由此說明,我們可以利用一氧化碳和氫氣的可燃性,根據它們燃燒產物不同來鑒別。那么能不能用這一性質鑒別一氧化碳和二氧化碳?
【板書】(2).一氧化碳的還原性
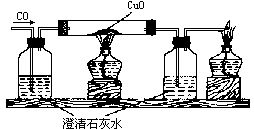 師:在用氫氣還原氧化銅實驗中,我們必須注意“兩先兩后”,即先通氣再點燃,先熄燈后停氣。一氧化碳也應這樣,請敘述理由。
師:在用氫氣還原氧化銅實驗中,我們必須注意“兩先兩后”,即先通氣再點燃,先熄燈后停氣。一氧化碳也應這樣,請敘述理由。
生:先通入一氧化碳,趕出試管內空氣,避免一氧化碳跟管內的空氣混合,受熱而引起爆炸。停止反應后,先熄滅酒精燈,仍繼續通一氧化碳,防止灼熱的銅遇到進入管內空氣又生成氧化銅。 【演示】一氧化碳還原氧化銅的實驗 師:實驗中看到哪些現象?
生:黑色固體變成紅色固體,生成的氣體能使澄清的石灰水變渾濁。 討論〕(1)此裝置和H2、C還原氧化銅有什么不同?(2)反應后生成的紅色粉末是什么?
講述】物質的性質決定物質的用途。
師:一氧化碳可作氣體燃料和用來冶煉金屬,請分別說明利用一氧化碳的哪些化學性質。
【板書】
【板書】四、一氧化碳的用途
1.作氣體燃料(可燃性)
2.冶煉金屬(還原性)
師:工業上利用一氧化碳的還原性,在煉鐵廠把鐵礦石還原成鐵。完成一氧化碳跟氧化鐵反應的化學方程式。生:Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
小結】通過本節學習,我們了解一氧化碳的各種性質,它既可能危害人類,又能造福于人民。我們只有掌握物質的性質,才能合理利用資源,防止污染,保護環境。一氧化碳 、二氧化碳性質比較:
對此物
項目
CO2(有反應的寫方程式)
CO(有反應的寫方程式)
備注
物理性質
化
學
性
質
跟水反應
跟石灰水反應
可燃性
驗純
點燃
還原性
氧化性
CO2 +C高溫2CO
無
毒性
不供呼吸,空氣中含量超 10%能使人死亡,無毒
有劇毒、空氣中1%也會死亡
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com