
【題目】表為元素周期表的一部分,用化學用語回答下列有關問題: 
(1)⑧的原子結構示意圖為:;
(2)②和③氣態氫化物穩定性大小順序是:(寫化學式);
(3)③、⑧、⑩的最高價含氧酸的酸性最強的是:(寫化學式);
(4)實驗室制取③的氣態氫化物的化學方程式為
③的氣態氫化物與③的最高價氧化物對應的水化物反應生成的鹽是(寫化學式),它屬于(選填“共價化合物”或“離子化合物”)
(5)①、④、⑩三種元素的原子能形成原子數目比為1:1:1的共價化合物,它的電式式為:
(6)欲比較④和⑨兩種元素非金屬性強弱,可以做為驗證的證據是(填序號).
A.比較這兩種元素單質的沸點
B.比較這兩種元素單質與氫氣化合的難易
C.比較這兩種元素的最高價氧化物水化物的酸堿性
D.比較這兩種元素單質與酸或堿反應的難易性.
【答案】
(1)
(2)NH3>CH4
(3)HClO4
(4)Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;NH4NO3;離子化合物
CaCl2+2NH3↑+2H2O;NH4NO3;離子化合物
(5)![]()
(6)C
【解析】解:由元素在周期表中位置,可知①為H、②為C、③為N、④為O、⑤為Na、⑥為Mg、⑦為Al、⑧為P、⑨為S、⑩為Cl.
(1.)⑧為P,質子數為15,原子核外有15個電子,由核外電子排布規律,原子結構示意圖為  ,所以答案是:
,所以答案是:  ;
;
(2.)同周期自左而右非金屬性增強,非金屬性越強,對應氫化物越穩定,故氫化物穩定性NH3>CH4 , 所以答案是:NH3>CH4;
(3.)最高價含氧酸的酸性最強的是高氯酸,化學式為HClO4 , 所以答案是:HClO4;
(4.)實驗室用氯化銨與氫氧化鈣再加熱條件下制備氨氣,反應方程式為:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O,③的氣態氫化物與③的最高價氧化物對應的水化物反應生成的鹽是NH4NO3 , 屬于離子化合物,所以答案是:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,③的氣態氫化物與③的最高價氧化物對應的水化物反應生成的鹽是NH4NO3 , 屬于離子化合物,所以答案是:Ca(OH)2+2NH4Cl ![]() CaCl2+2NH3↑+2H2O;NH4NO3;離子化合物;
CaCl2+2NH3↑+2H2O;NH4NO3;離子化合物;
(5.)①、④、⑩三種元素的原子能形成原子數目比為1:1:1的共價化合物為HClO,分子中氧原子分別與H原子、Cl原子形成1對共用電子對,電子式為: ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(6.)可以根據單質與氫氣反應難易程度或劇烈程度、最高價含氧酸的酸性、單質之間相互置換、化合物中元素化合價等判斷非金屬性強弱.
A.單質的沸點屬于物理性質,不能比較元素非金屬性強弱,故A錯誤;
B.非金屬性越強,單質與氫氣化合越容易,故B正確;
C.非金屬性越強,最高價氧化物水化物的酸性越強,但氧元素沒有含氧酸,故C錯誤;
D.通過單質與酸或堿反應不能判斷非金屬性強弱,故D錯誤.故選:B.


科目:高中化學 來源: 題型:
【題目】能在水溶液中大量共存的一組離子是
A.H+、I―、NO3―、SiO32-B.Ag+、Fe3+、Cl―、SO42―
C.K+、SO42-、Cu2+、NO3―D.NH4+、OH-、Cl-、HCO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素W,X,Y,Z在元素周期表中的位置如圖所示.下列說法中,正確的是( ) 
A.W的最高價氧化物對應的水化物是強酸
B.Y的原子半徑在同周期主族元素中最大
C.W的非金屬性比Z的弱
D.Z的氣態氫化物的穩定性在同主族元素中最強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】香煙煙霧中往往含有CO和SO2氣體,下列關于它們的說法中正確的是( )
A. 兩者都易溶于水
B. 兩者都是形成酸雨的主要原因
C. 兩者都能使品紅溶液褪色
D. 兩者都污染環境,危害健康
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人們常用“84”消毒液對環境進行消毒。該消毒液無色,對某些有色物質有漂白作用,對該溶液進行焰色反應,呈黃色。你認為它可能的有效成分是( )
A.NaOHB.NaClOC.KMnO4D.Na2CO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于金屬的敘述中正確的是( )
A. 常溫下所有的金屬都是固態
B. 金屬具有導電、導熱和延展性
C. 金屬都具有較高的硬度和密度
D. 金屬都具有較高的熔點和沸點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】縮醛在有機合成中常用于保護羰基或作為合成中間體,同時還是一類重要的香料,廣泛應用于化妝品、食物、飲料等行業。G是一種常用的縮醛,分子中含有一個六元環和一個五元環結構。下面是G的一種合成路線:
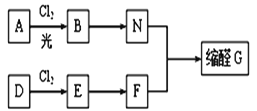
已知:①芳香烴A含氫元素的質量分數為8.7%,A的質譜圖中,分子離子峰對應的最大質荷比為92; D的產重可以用來衡量一個國家的石油化工發展水平。
②同一個碳原子連接兩個羥基不穩定,易脫水形成羰基。
③
回答下列問題:
(1)A的結構簡式是_____________________,E的名稱是____________________________。
(2)由D生成E的反應類型是________,E→F的反應條件是_________________________。
(3)由B生成N的化學方程式為___________________________。
(4)有研究發現,維生素C可以作為合成G物質的催化劑,具有價廉、效率高、污染物少的優點。維生素C的結構如右圖。則維生素C分子中含氧官能團名稱為_____________。

(5)縮醛G的結構簡式為______________。G有多種同分異構體,寫出其中能同時滿足以下條件的所有同分異構體的結構簡式:_________________________。
①既能發生銀鏡反應,又能與FeC13發生顯色反應;②核磁共振氫諧為4組峰。
(6)寫出用2-丁烯為原料(其他無機試劑任選)制備順丁橡膠(順式聚1,3-丁二烯)的合成路線:__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】霧霾的形成與汽車尾氣和燃煤有直接的關系,新近出版的《前沿科學》雜志刊發的中國環境科學研究院研究員的論文《汽車尾氣污染及其危害》,其中系統地闡述了汽車尾氣排放對大氣環境及人體健康造成的嚴重危害。
(1)用SO2氣體可以消除汽車尾氣中NO2, 已知NO2(g)+SO2(g)![]() SO3(g)+NO(g)。一定條件下,將NO2與SO2以物質的量比1∶2置于體積為1L 密閉容器中發生上述反應,測得上述反應平衡時NO2與SO2體積比為1∶6,則平衡常數K=____。
SO3(g)+NO(g)。一定條件下,將NO2與SO2以物質的量比1∶2置于體積為1L 密閉容器中發生上述反應,測得上述反應平衡時NO2與SO2體積比為1∶6,則平衡常數K=____。
(2)目前降低尾氣中的NO和CO可行方法是在汽車排氣管上安裝催化轉化器。NO和CO在催化轉換器中發生反應:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,將2.0mol NO、2.4mol氣體CO通入到固定容積為2L的容器中,反應過程中部分物質的濃度變化如圖所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,將2.0mol NO、2.4mol氣體CO通入到固定容積為2L的容器中,反應過程中部分物質的濃度變化如圖所示:

①有害氣體NO的轉化率為________。
②20min時,若改變反應條件,導致CO濃度減小,則改變的條件可能是_____(選填序號)。
a.縮小容器體積 b.增加CO的量 c.降低溫度 d.擴大容器體積
(3)消除汽車尾氣中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃燒熱△H=-c kJ·mol-1。寫出消除汽車尾氣中NO2的污染時,NO2與CO的反應的熱化學反應方程式 ____________________。
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=______________mol/L
②若向其中加入固體NH4Cl,使c(NH4+)的濃度達到0.20 mol/L,則c(OH-)=______mol/L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com