
【題目】如圖為某大型冶煉廠的冶煉加工的簡化工藝流程。
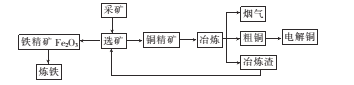
已知流程中“冶煉”的主要反應的化學方程式為Cu2S+O2 ![]() 2Cu+SO2
2Cu+SO2
(l)工業(yè)煉鐵的主要設備是煉鐵高爐,該設備中生成鐵的主要反應的化學方程式為________
(2)“冶煉”產生煙氣中的廢氣主要是 ___,從提高資源利用率和減排考慮,可將該煙氣回收制備____。
(3)電解法煉銅時,陽極是 ___(填“純銅板”或“粗銅板”);粗銅中含有的金、銀以單的形式沉積在電解槽____(填“陽極”或“陰極”)的槽底,陰極的電極反應式是_____
(4)在精煉銅的過程中,電解質溶液中c(Fe2+)、c(Zn2+)會逐漸增大而影響進一步電解。
已知幾種物質的溶度積常數(Ksp)如下表:

調節(jié)電解液的pH是除去雜質離子的常用方法。根據上表中溶度積數據判斷,含有等物質的量濃度的Fe2+、Zn2+、Fe3+、Cu2+的溶液,隨著pH的升高,最先沉淀下來的離子是____。一種方案是先加入過量的H2O2,再調節(jié)pH到4左右。加入H2O2后發(fā)生反應的離子方程式為____。
【答案】Fe2O3+3CO![]() 2Fe+3CO2 SO2 硫酸 粗銅板 陽極 Cu2++2e-=Cu Fe3+ 2Fe2++ H2O2+2H+=2Fe3++2H2O
2Fe+3CO2 SO2 硫酸 粗銅板 陽極 Cu2++2e-=Cu Fe3+ 2Fe2++ H2O2+2H+=2Fe3++2H2O
【解析】
(l)工業(yè)上用一氧化碳還原氧化鐵來冶煉鐵,據此寫出反應方程式;
(2)根據Cu2S+O2 ![]() 2Cu+SO2可知,可以看出煙氣中的主要廢氣是SO2,而SO2可以用于制備硫酸;
2Cu+SO2可知,可以看出煙氣中的主要廢氣是SO2,而SO2可以用于制備硫酸;
(3)電解法煉銅時,陽極是粗銅板,銅在陽極溶解,比銅活潑性差的金屬如金、銀以單質的形式沉在電解槽底部,形成陽極泥;
(4)通過表中數據可知Fe(OH)3溶度積最小,所以隨pH升高最先沉淀下來的離子是Fe3+;H2O2是強氧化劑,會把Fe2+ 氧化為鐵離子,據此寫出離子方程式。
(l)煉鐵高爐設備中生成鐵的主要反應的化學方程式為Fe2O3+3CO![]() 2Fe+3CO2;綜上所述,本題答案是:Fe2O3+3CO
2Fe+3CO2;綜上所述,本題答案是:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
(2)根據Cu2S+O2 ![]() 2Cu+SO2可知,可以看出煙氣中的主要廢氣是SO2,而SO2可以用于制備硫酸,符合提高資源利用率和減排的目標;綜上所述,本題答案是:SO2,硫酸。
2Cu+SO2可知,可以看出煙氣中的主要廢氣是SO2,而SO2可以用于制備硫酸,符合提高資源利用率和減排的目標;綜上所述,本題答案是:SO2,硫酸。
(3)電解法煉銅時,陽極是粗銅板,銅會放電生成銅離子,比銅活潑性差的金屬如金、銀以單質的形式沉在電解槽底部,形成陽極泥,方程式為Cu2++ 2e-=Cu;綜上所述,本題答案是:粗銅板;陽極;Cu2++ 2e-=Cu。
(4)Fe(OH)3的溶度積最小,假設各種金屬離子濃度均為1mol/L,Ksp[Fe(OH)3]=4×10-38=c(Fe3+)×c3(OH-),c3(OH-)=4×10-38,c(OH-)≈10-13mol/L,c(H+)=10-1mol/L,pH=1; Ksp[Cu(OH)2]=2.2×10-20= c(Cu2+)×c2(OH-),c2(OH-)=2.2×10-20,c(OH-)≈10-10mol/L,c(H+)=10-4mol/L,pH=4.所以,各種金屬離子開始沉淀的pH最小的是Fe3+,所以隨pH升高最先沉淀下來的離子是Fe3+;H2O2是強氧化劑,能夠把Fe2+氧化為Fe3+,方程式為:2Fe2++ H2O2+2H+=2Fe3++2H2O;綜上所述,本題答案是:Fe3+;2Fe2++H2O2+2H+=2Fe3++2H2O。


科目:高中化學 來源: 題型:
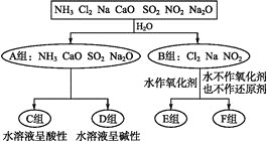
【題目】以下是依據一定的分類標準,對某些物質與水反應情況進行分類的圖示。
請根據你所學的知識,按要求填空:
(1)上述第一級分類標準(分成A,B組的依據)是____。
(2)F組中物質除了Cl2外還有____(填化學式)。
(3)A組中的CaO經常用作食品包裝袋中的干燥劑,CaO所屬的物質類型為____(用序號填空)。
①金屬氧化物 ②堿性氧化物 ③堿 ④堿性干燥劑
CaO可作干燥劑的理由是____________(用化學方程式表示)。
(4)D組中NH3的水溶液呈弱堿性,用電離方程式表示其呈弱堿性的原因:________。
(5)由Al3+制備Al(OH)3,最好不選擇D組中的NaOH溶液,說明理由:___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】桶烯結構簡式如圖所示,有關說法不正確的是 ( )
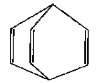
A.桶烯分子中所有的原子在同一平面上
B.桶烯在一定條件下能發(fā)生加聚反應
C.桶烯與苯乙烯(C6H5CH==CH2)互為同分異構體
D.桶烯中的一個氫原子被氯原子取代,所得產物只有兩種
查看答案和解析>>
科目:高中化學 來源: 題型:
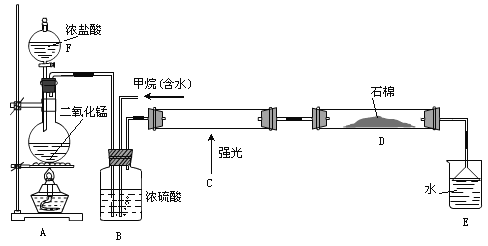
【題目】利用甲烷與氯氣發(fā)生取代反應制取副產品鹽酸的設想已成為現實。某化學興趣小組在實驗室中模擬上述過程(反應緩慢不發(fā)生爆炸),其設計的模擬裝置如下:
根據要求填空:
(1)儀器F的名稱______________;A中反應的離子反應方程式___________________。
(2)B裝置有三種功能:①控制氣流速度;②均勻混合氣體③______________________。
(3)為了除多余的氯氣,D裝置中的石棉網均勻附著KI粉末,你認為能否換成堿石灰______(填“能”或“不能”)。
(4)E裝置的作用________。
A.收集氣體 B.吸收氯氣 C.防止倒吸 D.吸收氯化氫
(5)E裝置中除了鹽酸生成外,還含有有機物,從E中分離出鹽酸的最佳方法:_____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在生物體內含量極少,但對維持生物體正常生命活動必不可少的元素有( )
A. Fe、Mn、Zn、Mg B. Zn、Cu、P、Ca
C. K、Mn、Cu、Mo D. Zn、Cu、B、Mn
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀鹽酸,CO2的生成量與加入鹽酸的體積的關系如圖。下列判斷正確的是
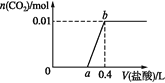
A. 在0~a范圍內,只發(fā)生中和反應
B. ab段發(fā)生反應的離子方程式為:![]()
C. a=0.3
D. 原混合溶液中NaOH與Na2CO3的物質的量之比為1∶2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知![]() 和
和![]() 可以相互轉化
可以相互轉化![]()
![]() 。現將一定量
。現將一定量![]() 和
和![]() 的混合氣體通入體積為1L的恒溫恒容的密閉容器中,反應物濃度隨時間變化關系如圖。下列說法不正確的是
的混合氣體通入體積為1L的恒溫恒容的密閉容器中,反應物濃度隨時間變化關系如圖。下列說法不正確的是
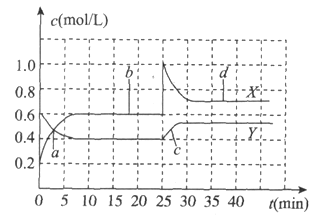
A. 反應進行至25min時,曲線發(fā)生變化的原因是加入0.4mol![]()
B. a、b、c、d四個點中,表示化學反應處于平衡狀態(tài)的點是b和d
C. 圖中共有兩條曲線X和Y,其中曲線X表示![]() 濃度隨時間的變化
濃度隨時間的變化
D. 若要達到與d相同的狀態(tài),在25min時還可以采取的措施是適當縮小容器體積
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)①寫出乙炔的結構式________________;②寫出水玻璃中溶質的化學式________________。
(2)寫出二氧化錳與濃鹽酸共熱反應的化學方程式:___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲酸鋁廣泛用于化工、石油等生產上,120150℃左右分解。在0℃時,溶解度為16g,100℃時,溶解度為18.4g。
首先用廢鋁渣制取AI(OH)3固體,流程如下:
![]()
(1)調節(jié)pH用_________試劑為好。某同學在減壓過濾時,布氏漏斗內沒有得到產品,可能原因是______________________。
然后將氫氧化鋁和甲醛依次加入到質量分數為50%的過氧化氫溶液中(投料物質的量之比依次為1∶3∶2),裝置如圖1.最終可得到含甲酸鋁90%以上的優(yōu)質產品。反應式為:2Al(OH)3+6HCHO+3H2O2=2Al(HCOO)3+6H2O+3H2↑。

(2)反應過程可看作兩步進行,第一步______________(寫出化學方程式),第二步為甲酸與Al(OH)3 反應生成甲酸鋁。
(3)反應溫度最好控制在30—70℃之間,溫度不宜過高,主要原因是_________________。
(4)實驗時需強力攪拌45 min,最后將溶液____________,抽濾,洗滌,干燥得產品。可用酸性KmnO4標準溶液滴定法來測定產品純度,滴定起始和終點的滴定管液面位置見上圖2, 則消耗的酸性KmnO4標準溶液體積為__________________mL。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com