
【題目】25℃時,用一定濃度NaOH溶液滴定某醋酸溶液,混合溶液的導電能力變化曲線如圖所示,其中b點為恰好反應點。下列說法不正確的是
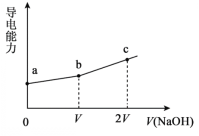
A.溶液的導電能力與離子種類和濃度有關
B.b點溶液的pH=7
C.a→c過程中,n(CH3COO-)不斷增大
D.c點的混合溶液中,c(Na+)>c(OH)>c(CH3COO-)
【答案】B
【解析】
A.不同離子所帶電荷量不同,導電能力不同;同種離子,濃度不同,導電能力也不同,A項正確;
B.由題可知,b點為恰好反應點,即滴定終點,此時溶液可視為醋酸鈉的水溶液,由于醋酸根水解,所以溶液顯堿性,常溫下,pH>7,B項錯誤;
C.a到b的過程,醋酸與加入的NaOH發生中和反應,醋酸的解離平衡正向移動,n(CH3COO-)逐漸增大;b到c的過程,由于溶液中NaOH的量逐漸增加,導致CH3COO-的水解平衡逆向移動,n(CH3COO-)逐漸增大;因此,從a到c的過程,n(CH3COO-)不斷增大,C項正確;
D.由題可知,c點的溶液可視為等濃度的NaOH與CH3COONa的混合溶液,由于醋酸根會發生水解,所以溶液中有:c(Na+)>c(OH-)>c(CH3COO-),D項正確;
答案選B。


 能力評價系列答案
能力評價系列答案 唐印文化課時測評系列答案
唐印文化課時測評系列答案 導學與測試系列答案
導學與測試系列答案科目:高中化學 來源: 題型:
【題目】已知2H2(g)+CO(g)![]() CH3OH(g)為放熱反應,對該反應的下列說法正確的是( )
CH3OH(g)為放熱反應,對該反應的下列說法正確的是( )
A.因該反應為放熱反應,故不加熱就可發生
B.相同條件下,2 mol H2的能量或1 mol CO 的能量一定高于1 mol CH3OH的能量
C.相同條件下,反應物2 mol H2和1 mol CO 的總能量一定高于生成物1 mol CH3OH(g)的總能量
D.達到平衡時,CO的濃度與CH3OH的濃度一定相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】色酮類化合物K具有抗菌、降血脂等生理活性,其合成路線如下:
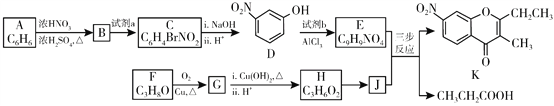
已知: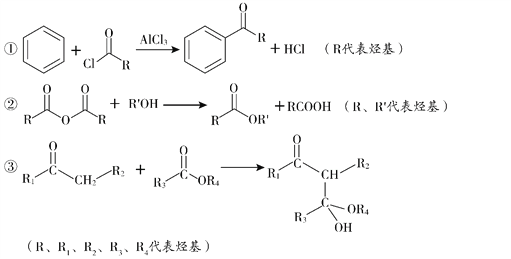
(1)A的結構簡式是_________;根據系統命名法,F的名稱是__________。
(2)B→C所需試劑a是__________;試劑b的結構簡式是_________。
(3)C與足量的NaOH反應的化學方程式為__________。
(4)G與新制Cu(OH)2反應的化學方程式為__________。
(5)已知:①2H![]() J+H2O;②J的核磁共振氫譜只有兩組峰。以E和J為原料合成K分為三步反應,寫出有關化合物的結構簡式:________。
J+H2O;②J的核磁共振氫譜只有兩組峰。以E和J為原料合成K分為三步反應,寫出有關化合物的結構簡式:________。
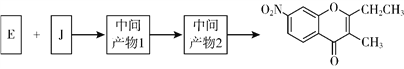
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在抗擊新冠肺炎的過程中,科研人員研究了法匹拉韋、利巴韋林、氯硝柳胺等藥物的療效,三種藥物主要成分的結構簡式如下。下列說法不正確的是
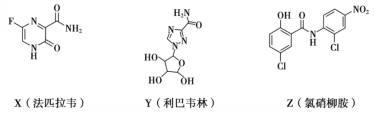
A.X的分子式為C5H4O2N3F
B.Z中含有6種官能團
C.Y和Z都有羥基,但性質不完全相同
D.X和Z都能發生加成反應和水解反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備溴苯的反應裝置如下圖所示,關于實驗操作的敘述錯誤的是
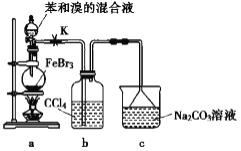
A. 向圓底燒瓶中滴加苯和溴的混合液前需先打開 K
B. 實驗中裝置 b 中的液體逐漸變為淺紅色
C. 反應后的混合液經稀堿溶液洗滌、結晶,得到溴苯
D. 裝置 c 中的碳酸鈉溶液的作用是吸收溴化氫
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚乙炔導電聚合物的合成使高分子材料進入了“合成金屬”和塑料電子學時代,當聚 乙炔分子帶上藥物、氨基酸等分子片段后,就具有了一定的生物活性。以下是我國化學家 近年來合成的聚乙炔衍生物分子 M 的結構式及 M 在稀硫酸作用下的水解過程。
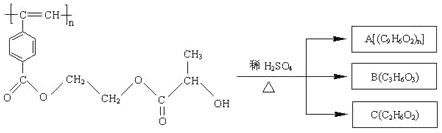
下列有關說法中不正確的是
A. M 與 A 均能使酸性高錳酸鉀溶液和溴水褪色
B. B 中含有兩種官能團,B 能發生消去反應和縮聚反應
C. A、B、C 各 1 mol 分別不足量金屬鈉反應,放出的氣體的物質的量之比為 1∶2∶2
D. 1 mol M 與熱的燒堿溶液反應,可消耗 2n mol 的 NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水氯化錳![]() 在電子技術和精細化工領域有重要應用。一種由粗錳粉(主要雜質為Fe、Ni、Pb等金屬單質)制備無水氯化錳的工藝如下(部分操作和條件略)。
在電子技術和精細化工領域有重要應用。一種由粗錳粉(主要雜質為Fe、Ni、Pb等金屬單質)制備無水氯化錳的工藝如下(部分操作和條件略)。
I.向粗錳粉中加入鹽酸,控制溶液的pH約為5,測定離子的初始濃度。靜置一段時間后錳粉仍略有剩余,過濾;
II.向I的濾液中加入一定量鹽酸,再加入![]() 溶液,充分反應后加入
溶液,充分反應后加入![]() 固體調節溶液的pH約為5,過濾;
固體調節溶液的pH約為5,過濾;
III.向II的濾液中通入![]() 氣體,待充分反應后加熱一段時間,冷卻后過濾;
氣體,待充分反應后加熱一段時間,冷卻后過濾;
IV.濃縮、結晶、過濾、洗滌、脫水得到無水MnCl2。
各步驟中對雜質離子的去除情況
|
|
| |
初始濃度/mg·L–1 | 21.02 | 4.95 | 5.86 |
步驟I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
步驟II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
步驟III后/ mg·L–1 | 0.10(達標) | 3.19(未達標) | 0.12(達標) |
已知:金屬活動性Mn>Fe>Ni>Pb
(1)錳和鹽酸反應的化學方程式是_______。
(2)步驟I中:
①Fe2+濃度降,濾渣中存在![]() 。結合離子方程式解釋原因:_______。
。結合離子方程式解釋原因:_______。
②Pb2+濃度降低,分析步驟I中發生的反應為:Pb + 2H+ = Pb2+ + H2↑、______。
(3)步驟II中:
①![]() 酸性溶液的作用:_______。
酸性溶液的作用:_______。
②結合離子方程式說明MnCO3的作用: _______。
(4)步驟III通入H2S后, Ni2+不達標而![]() 達標。推測溶解度:PbS_____NiS(填“>”或“<”)。
達標。推測溶解度:PbS_____NiS(填“>”或“<”)。
(5)測定無水![]() 的含量:將a g 樣品溶于一定量硫酸和磷酸的混合溶液中,加入稍過量
的含量:將a g 樣品溶于一定量硫酸和磷酸的混合溶液中,加入稍過量![]() ,使
,使![]() 氧化為
氧化為![]() 。待充分反應后持續加熱一段時間,冷卻后用b mol/L硫酸亞鐵銨
。待充分反應后持續加熱一段時間,冷卻后用b mol/L硫酸亞鐵銨![]() 滴定
滴定![]() ,消耗c mL 硫酸亞鐵銨。(已知:滴定過程中發生的反應為:Fe2+ + Mn3+ = Fe3+ + Mn2+)
,消耗c mL 硫酸亞鐵銨。(已知:滴定過程中發生的反應為:Fe2+ + Mn3+ = Fe3+ + Mn2+)
①樣品中MnCl2的質量分數是_____(已知:MnCl2的摩爾質量是126 g·mol-1)。
②“持續加熱”的目的是使過量的![]() 分解。若不加熱,測定結果會______(填“偏高”、“偏低”或“無影響”)。
分解。若不加熱,測定結果會______(填“偏高”、“偏低”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖(Ea表示活化能)是CH4與Cl2生成CH3Cl的部分反應過程中各物質物質的能量變化關系圖,下列說法正確的是( )
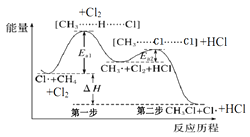
A.Cl·可由Cl2在高溫條件下生成,是CH4與Cl2反應的催化劑
B.升高溫度,Ea1、Ea2均減小,反應速率加快
C.增大Cl2的濃度,可提高反應速率,但不影響△H的大小
D.第一步反應的速率大于第二步反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列根據反應原理設計的應用,不正確的是
A. CO32-+H2O![]() HCO3-+OH- 熱的純堿溶液清洗油污
HCO3-+OH- 熱的純堿溶液清洗油污
B. Al3++3H2O![]() Al(OH)3+3H+ 明礬凈水
Al(OH)3+3H+ 明礬凈水
C. TiCl4+(x+2)H2O(過量) ![]() TiO2·xH2O↓+4HCl 用TiCl4制備TiO2
TiO2·xH2O↓+4HCl 用TiCl4制備TiO2
D. SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亞錫溶液時加入氫氧化鈉
Sn(OH)Cl↓+HCl 配制氯化亞錫溶液時加入氫氧化鈉
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com