①25℃,難溶電解質的溶度積常數:K
sp[CaF
2]=1.5×10
-10,K
sp[Mg(OH)
2]=1.8×10
-11,K
sp [Cu(OH)
2]=2.2×10
-20②弱電解質在水溶液中存在電離常數:例如一元弱酸HA
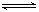
H
++A
-,其電離常數表達式 K
a=
c(H
+)·
c (A
-)/
c (HA)(各濃度為平衡時濃度)。該常數與濃度、壓強無關,只是溫度的函數。25℃,醋酸的K
a=1.76×10
-5③25℃時,2.0×10
-3mol·L
-1氫氟酸水溶液中,調節溶液pH(忽略體積變化),得到
c(HF)、
c(F
-)與溶液pH的變化關系,如下圖所示:
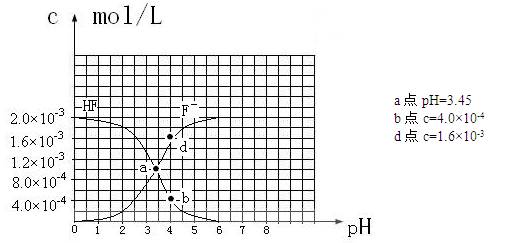
請根據以上信息回答下列問題:
(1)25℃時,向濃度均為0.1 mol·L
-1的MgCl
2和CuCl
2混合溶液中逐滴加入氨水,先生成__________沉淀(填化學式),生成該沉淀的離子方程式為
。
(2)25℃時,HF電離常數的數值Ka
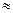
,列式并說明得出該常數的理由
。
(3)25℃時,向濃度均為0.1 mol·L
-1的相同體積的HF和醋酸兩種溶液中分別加入相同的足量鋅粒,初始時產生氫氣的速率關系為
(填“>”“=”或“<”,下同)。反應結束后,產生氫氣的物質的量的關系為
,兩溶液中
c (F
-)
c (CH
3COO
-)。
(4)25℃時,4.0×10
-3mol·L
-1HF溶液與4.0×10
-4 mol·L
-1 CaCl
2溶液等體積混合,調節混合液pH為4.0(忽略調節混合液體積的變化),通過列式計算說明是否有沉淀產生。
