
【題目】設NA表示阿伏加德羅常數的值,下列說法正確的是 ( )
A.5.6 g Fe和足量的鹽酸完全反應失去電子數為0.3 NA
B.常溫常壓下,200 g質量分數為17% 的H2O2溶液中含氧原子數目為NA
C.5.4g鋁與足量NaOH溶液反應電子轉移數為0.6NA
D.標況下,4.48L的水中含有H2O分子的數目為0.2NA
【答案】C
【解析】
A.5.6gFe的物質的量為:![]() =0.1mol,0.1mol Fe與足量鹽酸反應生成氯化亞鐵,失去0.2mol電子,即失去電子數為0.2NA,故A錯誤;
=0.1mol,0.1mol Fe與足量鹽酸反應生成氯化亞鐵,失去0.2mol電子,即失去電子數為0.2NA,故A錯誤;
B.200g質量分數為17%的H2O2溶液中,雙氧水的質量為:200g×17%=34g,雙氧水的物質的量為:![]() =1mol,含有2mol O原子,由于水分子中也含有氧原子,則該溶液中含氧原子數目大于2NA,故B錯誤;
=1mol,含有2mol O原子,由于水分子中也含有氧原子,則該溶液中含氧原子數目大于2NA,故B錯誤;
C.5.4g鋁的物質的量為:![]() =0.3mol,鋁與足量NaOH溶液反應的離子方程式為: 2Al +2OH-+2H2O=2AlO2-+3H2↑,根據關系式2Al
=0.3mol,鋁與足量NaOH溶液反應的離子方程式為: 2Al +2OH-+2H2O=2AlO2-+3H2↑,根據關系式2Al![]() 6e-可知,0.3mol鋁參與該反應時轉移了0.3mol
6e-可知,0.3mol鋁參與該反應時轉移了0.3mol![]() 2=0.6mol電子,即電子轉移數為0.6NA,故C正確;
2=0.6mol電子,即電子轉移數為0.6NA,故C正確;
D.標況下水不是氣體,不能使用標況下的氣體摩爾體積計算,故D錯誤;
故選C。


科目:高中化學 來源: 題型:
【題目】![]() 廣泛存在于天然氣等燃氣及廢水中,熱分解或氧化
廣泛存在于天然氣等燃氣及廢水中,熱分解或氧化![]() 有利于環境保護并回收硫資源。
有利于環境保護并回收硫資源。
(1)Binoist等進行了![]() 熱分解實驗:
熱分解實驗:![]() ,開始時,
,開始時,![]() 與
與![]() 的體積比為1:19.在壓強為
的體積比為1:19.在壓強為![]() 下測得在三種不同溫度下
下測得在三種不同溫度下![]() 的轉化率如圖1所示.
的轉化率如圖1所示.
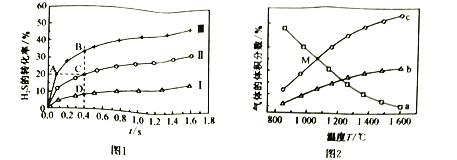
![]() 分解反應的
分解反應的![]() ______________(填“>”或“<”)0,A、B、C、D四點中:
______________(填“>”或“<”)0,A、B、C、D四點中:![]() 最大的是__________________,
最大的是__________________,![]() 最大的是___________,容器中
最大的是___________,容器中![]() 的分壓由大到小的關系是__________________。
的分壓由大到小的關系是__________________。
(2)當![]() 與
與![]() 混合,在
混合,在![]() 及不同溫度下反應達平衡時
及不同溫度下反應達平衡時![]() 及
及![]() 的體積分數如圖2所示。圖中b表示的物質是___________,M點時,反應
的體積分數如圖2所示。圖中b表示的物質是___________,M點時,反應![]() 的平衡常數
的平衡常數![]() ____________________
____________________![]() (
(![]() 為以分壓表示的平衡常數,保留兩位小數)
為以分壓表示的平衡常數,保留兩位小數)
(3)用氯氣除去廢水中![]() 的反應為
的反應為![]() ,該反應的可能機理如下:
,該反應的可能機理如下:
a.![]() 慢 b.
慢 b.![]() 快
快
![]() 快
快 ![]() 慢
慢
![]() 快
快 ![]() 快
快
c.![]() 慢 d.
慢 d.![]() 快
快
![]() 快
快 ![]() 慢
慢
①機理a的中間體為______________________。
②已知![]() ,
,![]() 為正反應速率,k為速率常數,上述機理中與該速率方程一致的是_________________________(填字母)。
為正反應速率,k為速率常數,上述機理中與該速率方程一致的是_________________________(填字母)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有著廣泛的用途。回答下列問題:
(1)畫出砷的原子結構示意圖____________。
(2)工業上常將含砷廢渣(主要成分為As2S3)制成漿狀,通入O2氧化,生成H3AsO4和單質硫。寫出發生反應的化學方程式________。該反應需要在加壓下進行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
則反應As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K時,將20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,發生反應:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)與反應時間(t)的關系如圖所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)與反應時間(t)的關系如圖所示。

①下列可判斷反應達到平衡的是__________(填標號)。
a.溶液的pH不再變化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再變化
d. c(I)=y mol·L1
②tm時,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm時v逆_____ tn時v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡時溶液的pH=14,則該反應的平衡常數K為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外時同學設計如下實驗裝置測定水的組成。
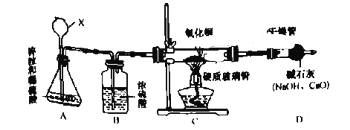
回答下列問題:
(1)儀器X的名稱為____________。
(2)裝置A中發生反應的化學方程式為______。
(3)當硬質玻璃管中固體由黑色轉變為紅色時,測得:①硬質玻璃管和其中固體的總質量反應后減少了1.6g;②干燥管的總質量在反應后增加了1.82g。由上述數據計算得出水中H、O元素的質量比為___(填最簡整數比)。
(4)甲同學經分析認為:該裝置存在缺陷,并對裝置進行改進,其方法是________(假設生成的水完全被D中堿石灰吸收,裝置內的水蒸氣、CO2忽略不計)。
(5)乙同學查閱資料知:CuO被還原的過程中可能有Cn2O(紅色)生成。若反應后硬質玻璃管中殘留固體含有Cu2O,是否會影響該實驗測定結果? _____________(填“影響”或“不影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綠原酸是咖啡的熱水提取液成分之一,結構簡式如下圖,關于綠原酸判斷正確的是( )

A.1 mol綠原酸與足量NaHCO3溶液反應,生成3 mol CO2氣體
B.1 mol綠原酸與足量溴水反應,最多消耗2.5 mol Br2
C.1 mol綠原酸與足量NaOH溶液反應,最多消耗4 mol NaOH
D.綠原酸水解產物均可以與FeCl3溶液發生顯色反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】藥用有機物A為一種無色液體。從A出發可發生如下一系列反應:
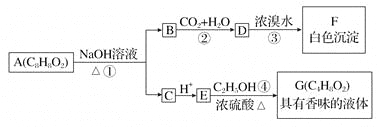
請回答:
(1)寫出化合物F的結構簡式:________________。
(2)寫出反應①的化學方程式:__________________________________________。
(3)寫出反應④的化學方程式:___________________________________________。
(4)有機物A的同分異構體很多,其中屬于羧酸類的化合物,且含有苯環結構的有________種。
(5)E的一種同分異構體H,已知H可以和金屬鈉反應放出氫氣,且在一定條件下可發生銀鏡反應。試寫出H的結構簡式:_________________________________。E的另一種同分異構體R在一定條件下也可以發生銀鏡反應,但不能和金屬鈉反應放出氫氣。試寫出R的結構簡式:_____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷酸亞鐵鋰(LiFePO4)電池是新能源汽車的動力電池之一。
(1)基態O原子核外電子排布式為_______,基態Fe2+核外未成對電子數為_______,基態P原子核外占據最高能級的電子云輪廓圖為_________形;
(2)比較大小(填“大于”、“小于”或“等于”):
①沸點:NH3_____PH3 ;②第一電離能:I1(P)_____I1(O)。
(3)PO43的空間構型是______,P原子的雜化形式為______,在1molPO43中含σ鍵______個。
(4)Li2O的晶胞如圖所示(其中白球代表Li,黑球代表O)。已知晶胞參數為0.4665 nm,阿伏加德羅常數的值為NA,則Li2O的密度為______g·cm3(列出計算式即可)。
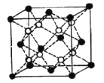
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是中學化學中常用于混合物的分離和提純的裝置
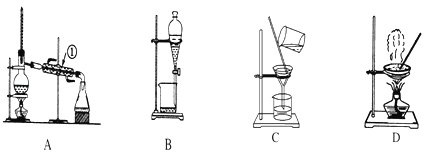
某化學興趣小組利用以上裝置,按以下實驗方案,采取步驟(1)(2)(3)(4)等四步操作從海洋動物中提取具有抗腫瘤活性的天然產物。(已知甲苯和甲醇均為有機溶劑,有機物大多能互溶)
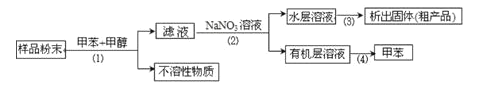
(1)裝置A中儀器①的作用是________,使用裝置A在流程中所對應的是________(填“操作(1)”“操作(2)”“操作(3)”或“操作(4)”,下同)。
(2)使用裝置B在流程中所對應的是________在該操作中,振蕩儀器時,為了避免因液體揮發而導致內部氣壓過大,還應進行的操作是________(填寫具體的操作方法)。
(3)使用裝置C在流程中所對應的是________,若所得沉淀不溶于水且需要洗滌,則洗滌的具體操作是________。
(4)使用裝置D在流程中所對應的是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com