
【題目】工業上利用廢鎳催化劑(主要成分為Ni,還含有一定量的Zn、Fe、SiO2、CaO等)制備草酸鎳晶體的流程如下:

(1)請寫出一種能提高“酸浸”速率的措施:___________________________________;濾渣I的成分是CaSO4和____________________(填化學式)。
(2)除鐵時,控制不同的條件可以得到不同的濾渣II。已知濾渣II的成分與溫度、pH的關系如圖所示:

①若控制溫度40℃、pH=8,則濾渣II的主要成分為___________(填化學式)。
②若控制溫度80℃、pH=2,可得到黃鐵礬鈉[Na2Fe6(SO4)4(OH)12]沉淀(圖中陰影部分),寫出生成黃鐵礬鈉的離子方程式:___________________________________________。
(3)已知除鐵后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,則所加c(NH4F)=_______mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有機萃取劑的作用是________________________。
【答案】把廢鎳催化劑粉碎、適當加熱,適當增大酸的濃度或攪拌等SiO2FeOOH2Na++3ClO-+6Fe2++4SO42-+9H2O=Na2Fe6(SO4)4(OH)12↓+3Cl-+6H+6.6×10-2除去溶液中的Zn2+
【解析】
廢鎳催化劑(主要成分為Ni,還含有一定量的Zn、Fe、SiO2、CaO等),用硫酸溶解,SiO2不與硫酸反應,過濾得到濾液中含有NiSO4、FeSO4、ZnSO4、CaSO4及過量的硫酸,濾渣I為SiO2和CaSO4微溶物,濾液中加入次氯酸鈉,將Fe2+氧化為Fe3+,同時調節pH,使Fe3+轉化為Fe(OH)3沉淀,所以濾渣II為鐵元素的沉淀,濾液中含有NiSO4、CaSO4,向濾液中加入NH4F,除去Ca2+,過濾,再加有機萃取劑除去溶液中的Zn2+,再向濾液中加入(NH4)2C2O4,得到草酸鎳沉淀,再過濾、洗滌、干燥得草酸鎳晶體,
(1)根據影響反應速率的因素答題;濾渣I主要為不溶于硫酸的SiO2和微溶物CaSO4;
(2)根據圖象可以知道,①控制溫度40℃、pH=8,則濾渣2的主要成分為FeOOH;
②Na2Fe6(SO4)4(OH)12中鐵元素化合價為+3價,可知ClO-將e2+氧化為Fe3+,依據氧化還原反應規律可寫出生成黃鐵礬鈉的離子方程式;
(3)根據反應式Ca2++2F-=CaF2↓,沉淀Ca2+消耗0.002molNH4F,根據Ksp(CaF2)=c(Ca2+)c2(F-)=5.29×10-9,沉淀Ca2+后,溶液中c(F-)=![]() ;
;
(4)根據流程圖,加入有機萃取劑的作用是除去溶液中的Zn2+。
(1)根據影響化學反應速率的因素可知,提高浸出率,可把廢鎳催化劑粉碎或適當加熱、適當增大硫酸濃度、攪拌等,濾渣I的成分是CaSO4和SiO2,
因此,本題正確答案是:把廢鎳催化劑粉碎、適當加熱,適當增大酸的濃度或攪拌等;SiO2;
(2)根據圖象可以知道,①控制溫度40℃、pH=8,則濾渣2的主要成分為FeOOH,
因此,本題正確答案是:FeOOH;
②若控制溫度80℃、pH=2,可得到黃鐵礬鈉[Na2Fe6(SO4)4(OH)12]沉淀,依據氧化還原反應規律寫出生成黃鐵礬鈉的離子方程式為:2Na++3ClO-+6Fe2++4SO42-+9H2O=Na2Fe6(SO4)4(OH)12↓+3Cl-+6H+;
因此,本題正確答案是:2Na++3ClO-+6Fe2++4SO42-+9H2O=Na2Fe6(SO4)4(OH)12↓+3Cl-+6H+;
(3)根據反應式Ca2++2F-=CaF2↓,沉淀Ca2+消耗0.002molNH4F,根據Ksp(CaF2)=c(Ca2+)c2(F-)=5.29×10-9,沉淀Ca2+后,溶液中c(F-)=![]() ,設加入c(NH4F)=cmol/L,則
,設加入c(NH4F)=cmol/L,則![]() =
=![]() ;解得c=6.6×10-2,
;解得c=6.6×10-2,
因此,本題正確答案是:6.6×10-2;
(4)根據流程圖,加入有機萃取劑的作用是除去溶液中的Zn2+,
因此,本題正確答案是:除去溶液中的Zn2+。


科目:高中化學 來源: 題型:
【題目】下列關于各實驗裝置及其使用的敘述中,正確的是(部分裝置未畫出)( )
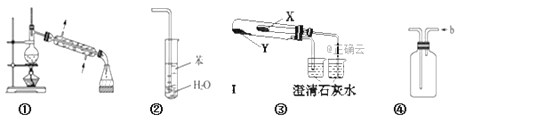
A. 裝置①常用于分離互不相溶的液體混合物
B. 裝置②可用于吸收NH3,并防止倒吸
C. 利用裝置③驗證KHCO3和K2CO3的熱穩定性,X中應放的物質是KHCO3
D. 裝置④ b口進氣可收集Cl2、NO等氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)與CO互為等電子體的分子和離子分別為______和______。
(2)以下列出的是一些原子的2p能級和3d能級中電子排布的情況,試判斷哪些違反了泡利原理__________,哪些違反了洪特規則__________。
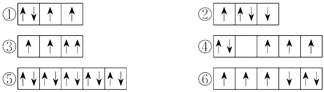
(3)某元素的激發態(不穩定狀態)原子的電子排布式為1s22s22p63s13p33d2,則該元素基態原子的電子排布式為__________;其最高價氧化物對應水化物的化學式是__________。
(4)將下列多電子原子的原子軌道按軌道能量由低到高順序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
軌道能量由低到高排列順序是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚合硫酸鐵是一種新型高效的無機高分子絮凝劑。用硫酸亞鐵晶體及硫酸為原料催化氧化法生成硫酸鐵,再水解、聚合成產品。實驗室模擬生產過程如下:
![]()
已知Fe3+能水解成氫氧化鐵:Fe3++3H2O===Fe(OH)3+3H+,為了防止Fe3+水解需加入硫酸。
(1)①用原料配制2.50 moL·L-1的硫酸亞鐵溶液時用到的定量儀器有_________________。
②寫出氧化過程中的離子方程式:________。
(2)綜合考慮實際投料硫酸亞鐵與硫酸的物質的量之比為1/1.25左右最佳,加入的硫酸比理論值稍多,但不能過多的原因是__________________________________。
(3)硫酸鐵溶液水解可以得到一系列具有凈水作用的堿式硫酸鐵(xFe2O3·ySO3·zH2O),現采用重量法測定x、y、z的值。
①測定時所需的試劑是______(填選項序號)。
A.NaOH B. Ba(OH)2
C.BaCl2D.FeSO4
②需要測定________和__________的質量(填寫化合物的化學式)。
(4)選出測定過程中所需的基本操作(按操作先后順序列出) ______________(填序號)。
①過濾、洗滌 ②蒸發、結晶 ③萃取、分液 ④冷卻、稱量 ⑤烘干或灼燒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C、N、S的氧化物常會造成一些環境問題,科研工作者正在研究用各種化學方法來消除這些物質對環境的影響。
(1)目前工業上有一種方法是用CO和H2在230℃,催化劑條件下轉化生成甲醇蒸汽和水蒸氣。圖一表示恒壓容器中0.5molCO2和1.5molH2轉化率達80%時的能量變化示意圖。寫出該反應的熱化學方程式__________________________________________。
(2)“亞硫酸鹽法”吸收煙氣中的SO2。室溫條件下,將煙氣通入(NH4)2SO3溶液中,測得溶液pH與含硫組分物質的量分數的變化關系如圖二所示。
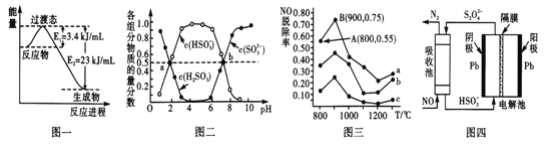
請寫出a點時n(HSO3-):n(H2SO3)=_____,b點時溶液pH=7,則n(NH4+):n(HSO3-)=_____。
(3)催化氧化法去除NO,一定條件下,用NH3消除NO污染,其反應原理為4NH3+6NO![]() 5N2+ 6H2O。不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4:l、3:l、1:3時,得到NO脫除率曲線如圖三所示:
5N2+ 6H2O。不同溫度條件下,n(NH3):n(NO)的物質的量之比分別為4:l、3:l、1:3時,得到NO脫除率曲線如圖三所示:
① 請寫出N2的電子式________。
② 曲線c對應NH3與NO的物質的量之比是______。
③ 曲線a中NO的起始濃度為6×10-4mg/m3,從A點到B點經過0.8s,該時間段內NO的脫除速率為_____mg/(m3·s)。
(4)間接電化學法可除NO。其原理如圖四所示,寫出電解池陰極的電極反應式(陰極室溶液呈酸性,加入HSO3-,出來S2O42-):____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A(C3H6)是基本有機化工原料。由A制備聚合物C和![]() 的合成路線(部分反應條件略去)如圖所示。
的合成路線(部分反應條件略去)如圖所示。
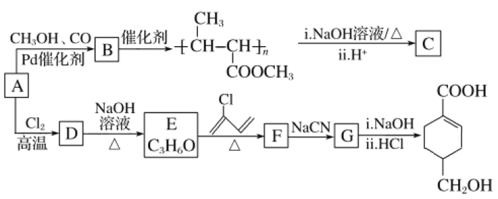
已知:![]() +‖
+‖![]()
![]() ;R—C≡N
;R—C≡N![]() R—COOH
R—COOH
回答下列問題:
(1)A的名稱是______________,B含有的官能團的名稱是________________(寫名稱)。
(2)C的結構簡式為________________,D→E的反應類型為_____________。
(3)E→F的化學方程式為_____________________________________________________。
(4)![]() 中最多有________個原子共平面。
中最多有________個原子共平面。
(5)B的同分異構體中,與B具有相同的官能團且能發生銀鏡反應的共有________種;其中核磁共振氫譜為3組峰,且峰面積之比為6∶1∶1的是_____________________(寫結構簡式)。
(6)結合題給信息,以乙烯、HBr為起始原料制備丙酸,設計合成路線(其他試劑任選) ______。合成路線流程圖示例:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁、戊是中學常見的無機物,其中甲、乙均為單質,它們的轉化關系如圖所示(某些條件和部分產物已略去)。下列說法不正確的是:
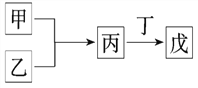
A. 若甲既能與鹽酸反應又能與NaOH溶液反應,則丙可能屬于兩性氧化物
B. 若丙、丁混合產生白煙,且丙為18電子分子,丁為10電子分子,則乙的水溶液可能具有漂白作用
C. 若甲為短周期中原子半徑最大的主族元素的單質,且戊為堿,則丙只能為Na2O2
D. 若甲、丙、戊含有同一種元素,則三種物質中,該元素的化合價由低到高的順序可能為甲<丙<戊
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁、戊是中學化學常見的無機物,其中甲、乙均為單質,它們的轉化關系如圖所示(某些條件和部分產物已略去)。下列說法不正確的是
( )。
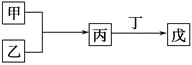
A. 若組成甲、乙的元素位于同一周期,則戊可能是一種弱酸
B. 若組成甲、乙的元素位于同一主族,則戊可能是一種弱酸
C. 若甲為短周期中原子半徑最大的主族元素形成的單質,且戊為堿,則丙只能為Na2O2
D. 若丙、丁混合生成白煙,且丙為18電子分子,丁為10電子分子,則乙的水溶液可能具有漂白作用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由一種短周期金屬元素和一種非金屬元素組成的化合物X可與水發生復分解反應。某校興趣小組用如圖裝置(夾持裝置略去)對其進行探究實驗。
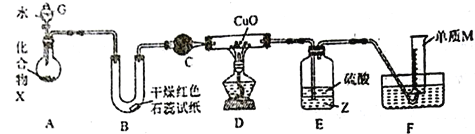
(1)儀器G的名稱是_____________________,B中紅色石蕊試紙變藍,則單質M的電子式為___________________。
(2)化合物X中含組成單質M的元素質量分數為16.9%,寫出X與水反應的化學方程式:_____________________________。
(3)C中的試劑名稱為___________________________。
(4)實驗時,裝置D中硬質玻璃管內的現象為_________________________。
(5)裝置E中試劑Z為___________(填化學式),裝置E的作用是_________________________。
(6)若不通過E、F兩裝置,請設計實驗方案證明D中發生了反應(不通過觀察D中固體顏色發生變化):__________________________________________________。
(7)若裝置A中固體樣品含有雜質(雜質不參與反應),某同學通過測定F中單質M在標準狀況下的體積和固體樣品的質量,以確定固體樣品中X的質量分數,判斷該方案是否可行,并說明原因:__________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com