
【題目】下列離子方程式書寫正確的是 ( )
A. 向水中通入氯氣:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向氯化鐵溶液中加入銅:2Fe3++3Cu===2Fe+3Cu2+
C. NH4HCO3溶液與過量KOH濃溶液共熱:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 向二氧化錳中滴加濃鹽酸并加熱:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
【答案】D
【解析】
A.次氯酸為弱電解質,不能拆;B.得失電子不守恒;C、缺少碳酸氫根離子與氫氧根離子反應生成碳酸根離子和水;D、實驗室用二氧化錳跟濃鹽酸加熱反應制取氯氣,生成氯化錳、氯氣和水。
A.向水中通入氯氣,離子方程式:Cl2+H2O═H++Cl-+HClO,選項A錯誤;B.向氯化鐵溶液中加入銅,離子方程式:2Fe3++Cu═2Fe2++Cu2+,選項B錯誤;C.NH4HCO3溶液與過量KOH濃溶液共熱,反應的離子方程式為NH4+++HCO3--+2OH-![]() NH3↑+CO32-+2H2O,選項C錯誤;D、向二氧化錳中滴加濃鹽酸并加熱:MnO2+4H++2Cl-
NH3↑+CO32-+2H2O,選項C錯誤;D、向二氧化錳中滴加濃鹽酸并加熱:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,選項D正確。答案選D。
Mn2++Cl2↑+2H2O,選項D正確。答案選D。


 應用題作業本系列答案
應用題作業本系列答案 暑假作業暑假快樂練西安出版社系列答案
暑假作業暑假快樂練西安出版社系列答案科目:高中化學 來源: 題型:
【題目】鐵及其化合物是日常生活生產中應用廣泛的材料。請回答下列問題:
(1)基態鐵原子的價電子軌道表達式為_____________________ 。
(2)鐵元素常見的離子有Fe2+和Fe3+,穩定性Fe2+____Fe3+(填“大于”“”或“小于”),原因是______________________ 。
(3)納米氧化鐵能催化火箭推進劑NH4ClO4的分解,NH4+的結構式為_________________(標出配位鍵),空間構型為_______________,其中氮原子的雜化方式為_______________;與ClO4-互為等電子體的分子或離子有______(任寫一種)。
(4)某種離子型鐵的氧化物晶胞如圖所示,它由A、B方塊組成。則該氧化物中Fe2+、Fe3+、O3-的個數比為___________(填最簡整數比)。
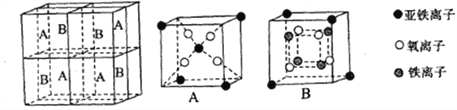
(5)鐵有δ、γ、α三種同素異形體,如下圖所示。

γ-Fe晶體的一個晶胞中所含有的鐵原子數為________,δ-Fe、α-Fe兩種晶胞中鐵原子的配位數之比為_________。
已知δ-Fe晶體的密度為dg/cm3,NA表示阿伏伽德羅常數的數值,則Fe原子半徑為_______Pm(列表達式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列有關溶液的說法正確的是( )
A. pH相等的①NH4Cl、②NH4Al(SO4)2、③NH4HSO4溶液:濃度的大小順序為①>②>③
B. HA的電離常數Ka =4.93×1010,則等濃度的NaA、HA混合溶液中:c(Na+) >c(HA) >c(A)
C. NaHCO3溶液加水稀釋,c(Na+)與c(HCO3)的比值將減小
D. 已知在相同條件下酸性HF >CH3COOH,則物質的量濃度相等的NaF與CH3COOK溶液中:c(Na+) – c(F) >c(K+ ) c(CH3COO)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉、碳及它們的化合物在生產、生活中有著重要的用途。
(1)某汽車安全氣囊的產氣藥劑主要含有NaN3、Fe2O3、KClO4、NaHCO3等物質。當汽車發生碰撞時,NaN3迅速分解產生N2和Na,同時放出大量的熱。N2使氣囊迅速膨脹,從而起到保護作用。
① KClO4中氯元素的化合價是_______,具有_______(填“還原性”或“氧化性”)。
② Fe2O3可處理產生的Na,反應為6Na + Fe2O3 =3Na2O + 2Fe,反應中Na做______(填“還原劑”或“氧化劑”)。
③ NaHCO3是冷卻劑,吸收產氣過程中釋放的熱量而分解,其分解的化學方程式是_______。
(2)Na2O2可用于呼吸面具或潛水艇中氧氣的來源。某實驗小組利用下圖裝置探究Na2O2與CO2的反應。請回答下列問題:
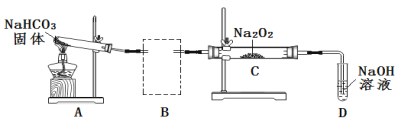
① 根據實驗目的,將虛線框中的裝置補充完整并標出所用的試劑_______。
② 裝置C中觀察到的現象是_______,反應的化學方程式是_______。
③ 裝置D的作用是吸收未反應的CO2便于O2的檢驗。吸收CO2的離子方程式是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵元素在地殼中含量豐富。下列有關說法不正確的是
A. 不銹鋼屬于鐵合金B. 用KSCN溶液可檢驗溶液中的Fe3+
C. 鐵制品腐蝕過程中鐵被還原D. 浸在有機溶劑溶液中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na2S2O3是重要的化工原料,易溶于水,在中性或堿性環境中穩定。

Ⅰ.制備Na2S2O3·5H2O
反應原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
實驗步驟:
①稱取15 g Na2SO3加入圓底燒瓶中,再加入80 mL蒸餾水。另取5 g研細的硫粉,用3 mL乙醇潤濕,加入上述溶液中。
②安裝實驗裝置(如圖所示,部分夾持裝置略去),水浴加熱,微沸60 min。
③趁熱過濾,將濾液水浴加熱濃縮,冷卻析出Na2S2O3·5H2O,經過濾、洗滌、干燥,得到產品。
回答問題:
(1)硫粉在反應前用乙醇潤濕的目的是__________________________。
(2)儀器a的名稱是________,其作用是____________________。
(3)產品中除了有未反應的Na2SO3外,最可能存在的無機雜質是______________。檢驗是否存在該雜質的方法是___________________________。
(4)該實驗一般控制在堿性環境下進行,否則產品發黃,用離子反應方程式表示其原因:____________。
Ⅱ.測定產品純度
準確稱取W g產品,用適量蒸餾水溶解,以淀粉作指示劑,用0.100 0 mol·L-1碘的標準溶液滴定。
反應原理為2S2O32—+I2===S4O62—+2I-
(5)滴定至終點時,溶液顏色的變化:____________________________________________。
(6)滴定起始和終點的液面位置如圖,則消耗碘的標準溶液體積為__________mL。產品的純度為(設Na2S2O3·5H2O相對分子質量為M)______________。

Ⅲ.Na2S2O3的應用
(7)Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO42—,常用作脫氯劑,該反應的離子方程式為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴結構式如下:![]() ,有關其結構說法正確的是
,有關其結構說法正確的是
A. 所有原子可能在同一平面上 B. 該分子不存在順反異構
C. 所有碳原子可能在同一平面上 D. 1 mol 該烴最多可與4 mol氫氣反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反應(已知NO3-被還原為NO),最終溶液體積為1L。下列說法正確的是
A. 所得溶液中c(NO3-)=2.75 mol·L-1
B. 所得溶液中c(Fe2+):c(Fe3+)=1:2
C. 反應后生成NO的體積為33.6 L(標準狀況下)
D. 所得溶液中的溶質只有FeSO4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com