
【題目】國際計量大會第26次會議新修訂了阿伏加德羅常數(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列說法正確的是( )
A.在Al3+數目為NA的AlCl3溶液中,Cl-總數為3 NA
B.常溫下,42g乙烯和丙烯的混合物中所含H原子的數目是6 NA
C.4molNH3與6molO2在催化劑和加熱條件下充分反應,所得產物中NO的分子數是4 NA
D.常溫常壓下,2g羥基(![]() )中所含的中子數為NA
)中所含的中子數為NA
科目:高中化學 來源: 題型:
【題目】鎂、鋁、鐵及其化合物在生產和生活中有廣泛的應用。
(1)鎂鋁合金用在飛機制造業,現有3.90克鎂鋁合金溶于足量的2mol/L稀硫酸中生成0.2mol氫氣,計算并確定鎂鋁合金中物質的量n(Mg): n(Al)=________。
(2)硫鐵礦的主要成分為FeS2(假設雜質只含SiO2)是生產硫酸的原料。取某硫鐵礦10g在足量的空氣中煅燒(4FeS2+11O2=2Fe2O3+8SO2),充分反應后冷卻,稱得固體質量為7.4g(雜質SiO2不反應)。該硫鐵礦中FeS2的質量分數為_____。
(3)現有一定量的鐵粉和鋁粉組成的混合物跟100 mL稀硝酸充分反應,反應過程中無任何氣體放出,往反應后的澄清溶液中逐漸加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的體積與產生沉淀的質量的關系如圖所示(必要時可加熱,忽略氣體在水中的溶解),縱坐標中A點的數值是________。
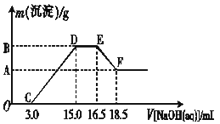
(4)煉鐵廠生產的生鐵常用于煉鋼。取某鋼樣粉末28.12g(假設只含Fe和C),在氧氣流中充分反應,得到CO2氣體224mL(標準狀況下)。
①計算此鋼樣粉末中鐵和碳的物質的量之比為________________(最簡單的整數比)。
②再取三份不同質量的上述鋼樣粉末分別加到100mL相同濃度的稀H2SO4中,充分反應后,測得的實驗數據如下表所示:
實驗序號 | Ⅰ | Ⅱ | Ⅲ |
加入鋼樣粉末的質量(g) | 2.812 | 5.624 | 8.436 |
生成氣體的體積(L)(標準狀況) | 1.120 | 2.240 | 2.800 |
則該硫酸溶液的物質的量濃度為__________________。
③若在上述實驗Ⅱ中繼續加入m克鋼樣粉末,計算反應結束后剩余的固體質量為___g(保留3位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知烴B分子內C、H原子個數比為1︰2,相對分子質量為28,核磁共振氫譜顯示分子中只有一種化學環境的氫原子,且有如下的轉化關系:
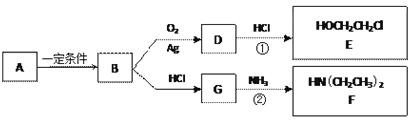
(1)B的結構簡式是_________________
(2)A可能屬于下列哪類物質___________
a.醇 b.鹵代烴 c.酚 d.羧酸
(3)反應①是D與HCl按物質的量之比1︰1的加成反應,則D的分子式是___________。
反應②可表示為:G + NH3→ F + HCl (未配平),該反應配平后的化學方程式是(有機化合物均用結構簡式表示): ____________________________________
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是藥品普魯卡因合成的重要中間體,普魯卡因的合成路線如下:(已知:![]() )
)

(4)甲的結構簡式是 _________________。
由甲苯生成甲的反應類型是_________________。
(5)乙中有兩種含氧官能團,反應③的化學方程式是___________________________________
(6)丙中官能團的名稱是_______________________________________。
(7)普魯卡因有兩種水解產物丁和戊。
① 戊與甲互為同分異構體,戊的結構簡式是_____________________。
② 戊經聚合反應制成的高分子纖維廣泛用于通訊、宇航等領域。該聚合反應的化學方程式是__________________________________________。
③ D的紅外光譜表明分子內除C—H鍵、C—C鍵外還含有兩個C—O單鍵。則D與F在一定條件下反應生成丁的化學方程式是________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列圖示所得結論正確的是
A.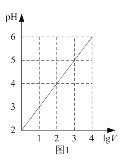 圖1表示1 LpH=2的某一元酸加水稀釋至V L,pH隨lgV的變化,說明該酸是弱酸
圖1表示1 LpH=2的某一元酸加水稀釋至V L,pH隨lgV的變化,說明該酸是弱酸
B.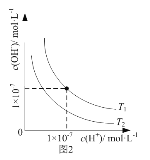 圖2表示不同溫度下水溶液中H+和OH-濃度的變化的曲線,說明圖中溫度T2>T1
圖2表示不同溫度下水溶液中H+和OH-濃度的變化的曲線,說明圖中溫度T2>T1
C.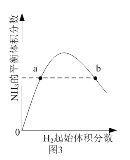 圖3表示一定條件下的合成氨反應中,NH3的平衡體積分數隨H2起始體積分數(N2的起始量恒定)的變化,說明圖中a點N2的轉化率小于b點
圖3表示一定條件下的合成氨反應中,NH3的平衡體積分數隨H2起始體積分數(N2的起始量恒定)的變化,說明圖中a點N2的轉化率小于b點
D.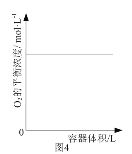 圖4表示同一溫度下,在不同容積的容器中進行反應2BaO2(s)
圖4表示同一溫度下,在不同容積的容器中進行反應2BaO2(s)![]() 2BaO(s)+O2(g), O2的平衡濃度與容器容積的關系,說明改變壓強平衡不發生移動
2BaO(s)+O2(g), O2的平衡濃度與容器容積的關系,說明改變壓強平衡不發生移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究汽車尾氣的產生、轉化對環境保護有重要意義。汽車尾氣管中的三元催化劑能同時實現CO、CxHy、NOn三種成分的凈化。
(1)已知熱化學方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
則反應CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=____kJ·mol-1。
(2)研究表明,溫度對CO、CxHy、NOn的產生和排放有較大影響。
①汽車發動機內的溫度越高,生成的NO越多,原因是____。
②當汽車剛冷啟動時,汽車尾氣管排放的CO、CxHy、NOn濃度較高,一段時間后濃度逐漸降低。汽車剛冷啟動時排放CO、CxHy、NOn濃度較高的原因是____。
(3)催化劑表面CO、CxHy、NOn的轉化如圖1所示,化合物W可借助圖2 (傅里葉紅外光譜圖)確定。
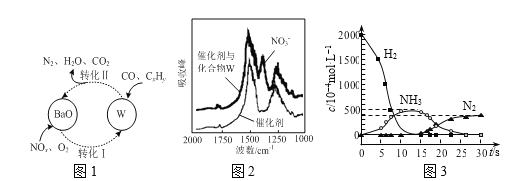
①在圖1所示轉化中,W的化學式為____。若轉化Ⅱ中消耗CO的物質的量為1mol,生成N2的物質的量為1mol,則被CxHy還原的W的物質的量為____。
②用H2代替CO、CxHy與W反應,該過程相關物質濃度隨時間的變化關系如圖3所示。該過程分為兩步,第一步反應消耗的H2與W的物質的量之比是____。
(4)尾氣凈化過程中,有時會產生N2O。用同位素示蹤法研究發現N2O的產生與NO有關。在有氧條件下15NO與NH3以一定比例反應時,得到的N2O幾乎都是15NNO。寫出該反應的化學方程式:____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烷的分子結構可簡寫成鍵線式結構![]() ,有機物A的鍵線式結構為
,有機物A的鍵線式結構為![]() ,有機物B與等物質的量的H2發生加成反應可得到有機物A。下列有關說法錯誤的是( )
,有機物B與等物質的量的H2發生加成反應可得到有機物A。下列有關說法錯誤的是( )
A. 用系統命名法命名有機物A,名稱為2,2,3﹣三甲基戊烷
B. 有機物A的一氯取代物只有4種
C. 有機物A的分子式為C8H18
D. B的結構可能有3種,其中一種名稱為3,4,4﹣三甲基﹣2﹣戊烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知干冰晶胞屬于面心立方最密堆積,晶胞中相鄰最近的兩個CO2分子間距為a pm,阿伏加德羅常數為NA,下列說法正確的是
A.晶胞中一個CO2分子的配位數是8
B.晶胞的密度表達式是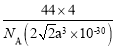 g·cm-3
g·cm-3
C.一個晶胞中平均含6個CO2分子
D.CO2分子的立體構型是直線形,中心C原子的雜化類型是sp3雜化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應敘述相符的是
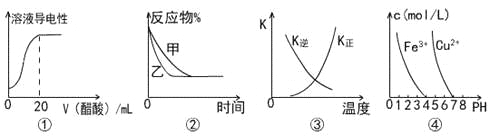
A.圖①表示向20 mL 0.1 mol/L氨水中逐滴加入0.1 mol/L醋酸,溶液導電性隨加入酸體積的變化
B.圖②表示壓強對可逆反應A(g)+2B(g)![]() 3C(g)+D(s)的影響,乙的壓強比甲的壓強大
3C(g)+D(s)的影響,乙的壓強比甲的壓強大
C.圖③中曲線表示反應3A(g) + B(g)![]() 2C(g)△H<0,正、逆反應的平衡常數K隨溫度的變化
2C(g)△H<0,正、逆反應的平衡常數K隨溫度的變化
D.據圖④,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國某科研團隊設計了一種新型能量存儲/轉化裝置(如下圖所示)。閉合K2、斷開K1時,制氫并儲能;斷開K2、閉合K1時,供電。下列說法錯誤的是
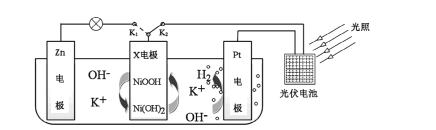
A.制氫時,溶液中K+向Pt電極移動
B.制氫時,X電極反應式為![]()
C.供電時,Zn電極附近溶液的pH降低
D.供電時,裝置中的總反應為![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com