
【題目】二甲醚又稱甲醚,簡稱DME,熔點-141.5℃,沸點-24.9℃,與石油液化氣(LPG)相似,被譽為“21世紀的清潔燃料”。制備原理如下:
Ⅰ.由天然氣催化制備二甲醚:
①2CH4(g)+O2(g)![]() CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
Ⅱ.由合成氣制備二甲醚:
②CO(g)+2H2(g)![]() CH3OH(g) △H2=-90.7kJ·mol-1
CH3OH(g) △H2=-90.7kJ·mol-1
③2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3
CH3OCH3(g)+H2O(g) △H3
回答下列問題:
(1)若甲烷和二甲醚的燃燒熱分別是890.3kJ·mol-1、1453.0 kJ·mol-1;1mol液態(tài)水變?yōu)闅鈶B(tài)水要吸收44.0kJ的熱量。反應③中的相關的化學健鍵能數(shù)據(jù)如表:
化學鍵 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E/(kJ mol-1) | 436 | 343 | 465 | 453 | 413 |
則△H1=_________kJ·mol-1 △H3=_________ kJ·mol-1
(2)反應③的化學平衡常數(shù)表達式為______________。制備原理Ⅰ中,在恒溫、恒容的密閉容器中合成,將氣體按n(CH4):n(O2)=2:1混合,能正確反映反應①中CH4的體積分數(shù)隨溫度變化的曲線是_________________。下列能表明反應①達到化學平衡狀態(tài)的是_______________。
a.混合氣體的密度不變
b.反應容器中二甲醚的百分含量不變
c.反應物的反應速率與生成物的反應速率之比等于化學計量數(shù)之比
d.混合氣體的壓強不變

(3)有人模擬制備原理Ⅱ,在500K時的2L的密閉容器中充入2molCO和6molH2,8min達到平衡,平衡使CO的轉化率為80%,c(CH3OCH3)=0.3mol·L-1,用H2表示反應②的速率是__________;可逆反應③的平衡常數(shù)K3=_________。若在500K時,測得容器中n(CH3OH)=n(CH3OCH3),此時反應③v(正)___v(逆),說明原因____________________。
【答案】 -283.6kJmol-1 -24kJ·mol-1 ![]() M bd 0.2mol/(Lmin) 2.25 > 濃度商Q=
M bd 0.2mol/(Lmin) 2.25 > 濃度商Q=![]() =
=![]() =1<2.25,反應正向進行,v(正)> v(逆)
=1<2.25,反應正向進行,v(正)> v(逆)
【解析】(1)若甲烷和二甲醚的燃燒熱分別是890.3kJ·mol-1、1453.0 kJ·mol-1;得到甲烷、二甲醚的燃燒熱化學方程式分別為:④CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) △H4=-890.3kJ·mol-1
CO2(g)+2H2O(l) △H4=-890.3kJ·mol-1
⑤CH3OCH3(g)+3O2(g)![]() 2CO2(g)+3H2O(l) △H5=-1453.0kJ·mol-1
2CO2(g)+3H2O(l) △H5=-1453.0kJ·mol-1
故④×2-⑤=①得到:2CH4(g)+O2(g)![]() CH3OCH3(g)+H2O(l),且1mol液態(tài)水變?yōu)闅鈶B(tài)水要吸收44.0kJ的熱量,故則△H1=(-890.3×2+1453+44.0) kJ·mol-1=-283.6kJmol-1,根據(jù)所給鍵能,③2CH3OH(g)
CH3OCH3(g)+H2O(l),且1mol液態(tài)水變?yōu)闅鈶B(tài)水要吸收44.0kJ的熱量,故則△H1=(-890.3×2+1453+44.0) kJ·mol-1=-283.6kJmol-1,根據(jù)所給鍵能,③2CH3OH(g)![]() CH3OCH3(g)+H2O(g) 反應物總鍵能-生成物總鍵能=反應熱 故△H3=-24kJ·mol-1;
CH3OCH3(g)+H2O(g) 反應物總鍵能-生成物總鍵能=反應熱 故△H3=-24kJ·mol-1;
(2)反應③的化學平衡常數(shù)表達式為K= ![]() ,反應①是放熱反應,故溫度升高,平衡逆向移動,CH4的體積分數(shù)隨溫度升高而升高,故能正確反映反應①中CH4的體積分數(shù)隨溫度變化的曲線是M;制備原理Ⅰ中,由于是在恒溫、恒容的密閉容器中合成,且反應①各物質均是氣態(tài),a、混合氣體的密度一直不變,不能說明達到平衡狀態(tài);b、當反應容器中二甲醚的百分含量不變時,該反應達到平衡狀態(tài),故b正確;c、反應物的反應速率與生成物的反應速率之比等于化學計量數(shù)之比在仍何時候都成立,故c錯誤;d、該裝置是恒容容器,混合氣體的壓強不變,說明氣體總物質的量不變,且該反應前后氣體分子總數(shù)不等,故d正確;故選bd;
,反應①是放熱反應,故溫度升高,平衡逆向移動,CH4的體積分數(shù)隨溫度升高而升高,故能正確反映反應①中CH4的體積分數(shù)隨溫度變化的曲線是M;制備原理Ⅰ中,由于是在恒溫、恒容的密閉容器中合成,且反應①各物質均是氣態(tài),a、混合氣體的密度一直不變,不能說明達到平衡狀態(tài);b、當反應容器中二甲醚的百分含量不變時,該反應達到平衡狀態(tài),故b正確;c、反應物的反應速率與生成物的反應速率之比等于化學計量數(shù)之比在仍何時候都成立,故c錯誤;d、該裝置是恒容容器,混合氣體的壓強不變,說明氣體總物質的量不變,且該反應前后氣體分子總數(shù)不等,故d正確;故選bd;
(3)Ⅱ.由合成氣制備二甲醚:
②CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始時(mol/L) 1 3 0
轉化(mol/L) 0.8 1.6 0.8
平衡時(mol/L) 0.2 1.4 0.8
③2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
起始時(mol/L) 0.8 0 0
轉化(mol/L) 0.6 0.3 0.3
平衡時(mol/L) 0.2 0.3 0.3
H2表示反應②的速率是c(H2)=![]() =0.2mol/(L·min);
=0.2mol/(L·min);
可逆反應③的平衡常數(shù)K3=![]() =
=![]() =2.25;
=2.25;
若在500K時,測得容器中n(CH3OH)=n(CH3OCH3),則說明c(CH3OH)=c(CH3OCH3)c(H2),則此時Q=![]() =
=![]() =1<2.25,故反應正向進行,v(正)> v(逆)。
=1<2.25,故反應正向進行,v(正)> v(逆)。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】水合肼(N2H4·H2O)是一種強還原性的堿性液體,常用作火箭燃料。利用尿素法生產(chǎn)水合肼的原理為CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
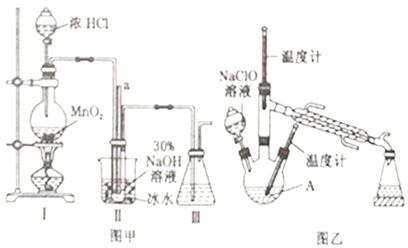
實驗1:制備NaClO溶液(己知:3NaClO![]() 2NaCl+NaClO3)。
2NaCl+NaClO3)。
(1)圖甲裝置Ⅰ中燒瓶內發(fā)生反應的離子方程式為________________________。
(2)用NaOH固體配制溶質質量分數(shù)為30%的NaOH溶液時,所需玻璃儀器有_______________。
(3)圖甲裝置Ⅱ中用冰水浴控制溫度的目的是________________________。
實驗2:制取水合肼
(4)圖乙中若分液漏斗滴液速度過快,部分N2H4·H2O會參與A 中反應并產(chǎn)生大量氮氣,降低產(chǎn)品產(chǎn)率,該過程中反應生成氮氣的化學方程式為__________________。充分反應后,蒸餾A中溶液即可得到水合肼的粗產(chǎn)品。
實驗3:測定餾分中水合肼的含量
(5)稱取餾分3.0g,加入適量NaHCO3固體(滴定過程中,調節(jié)溶液的pH 保持在6.5 左右),加水配成250mL溶液,移出25.00mL置于錐形瓶中,并滴加2~3 滴淀粉溶液。用0.15mol·L-1的碘的標準溶液滴定。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定操作中若不加入適量NaHCO3固體,則測量結果會___________“偏大”“ 偏小”“ 無影響”)。
②下列能導致餾分中水合肼的含量測定結果偏高的是___________(填字母)。
a.錐形瓶清洗干凈后未干燥
b.滴定前,滴定管內無氣泡,滴定后有氣泡
c.讀數(shù)時,滴定前平視,滴定后俯視
d.盛標準液的滴定管水洗后,直接裝標準液
③實驗測得消耗I2溶液的平均值為20.00mL,餾分中水合肼(N2H4·H2O)的質量分數(shù)為___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為測定某氟化稀土樣品中氟元素的質量分數(shù),某化學興趣小組進行如下了實驗。
利用高氯酸(高沸點酸)將樣品中的氟元素轉化為氟化氫(低沸點酸)蒸出,再通過滴定測量。
實驗裝置如圖所示。

(1)a的作用是____________,儀器d的名稱是________________ 。
(2)檢查裝置氣密性:____________(填操作),關閉k,微熱c,導管e末端有氣泡冒出;停止加熱,導管e內有一段穩(wěn)定的水柱,說明裝置氣密性良好。
(3)c中加入一定體積高氯酸和mg氟化稀土樣品,Z中盛有滴加酚酞的NaOH溶液。加熱b、c,使b中產(chǎn)生的水蒸氣進入c。
①下列物質可代替高氯酸的是_________(填序號)。
A.硝酸 B.鹽酸 C.硫酸 D.磷酸
②實驗中除有HF氣體外,可能還有少量SiF4(易水解)氣體生成。若有SiF4生成,實驗結果將__________(填“偏高”“ 偏低”或“不受影響”)。
③若觀察到f中溶液紅色褪去,需要向f中及時補加NaOH溶液,否則會使實驗結果偏低,原因是______________。
(4)向餾出液中加入V1mL c1mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2mol·L-1EDTA標準溶液滴定剩余La3+(La3+與EDTA按1:1絡合),消耗EDTA標準溶液V2ml,則氟化稀土樣品中氟的質量分數(shù)為______________。
(5)用樣品進行實驗前,需要用0.084g氟化鈉代替樣品進行實驗,改變條件(高氯酸用量、反應溫度、蒸餾時間),測量并計算出氟元素質量,重復多次。該操作的目的是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.MgF2晶體中的化學鍵是共價鍵
B.某物質在熔融態(tài)能導電,則該物質中一定含有離子鍵
C.N2和Cl2兩種分子中,每個原子的最外層都具有8電子穩(wěn)定結構
D.干冰是分子晶體,其溶于水生成碳酸的過程只需克服分子間作用力
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一個化學電池的總反應方程式為:Zn+Cu2+═Zn2++Cu,該化學電池的組成可能為( )
A | B | C | D | |
正極 | Cu | Cu | Zn | Al |
負極 | Zn | Zn | Cu | Zn |
電解質溶液 | H2SO4 | CuSO4 | ZnCl2 | Cu Cl2 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 為了使嬰兒對食品有更濃厚的興趣,應在嬰兒食品中加入大量的著色劑
B. 為了使火腿腸顏色更鮮紅,可多加入一些亞硝酸鈉
C. 豆腐的制作,涉及到了膠體的性質
D. 純凈水不含任何化學物質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的是( )
A. 共價化合物中不可能含有離子鍵
B. 有共價鍵的化合物,不一定是共價化合物
C. 離子化合物中可能存在共價鍵
D. 以極性鍵結合的分子,肯定是極性分子
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com