
【題目】某工廠排出的廢水中含有大量的Fe2+、Cu2+和SO42-.
Ⅰ.某校研究性學習小組設計如圖流程以回收銅和硫酸亞鐵.請回答:

(1)反應①的離子方程式為__________________。
(2)操作①中用到的玻璃儀器是_______________(填序號)。
a.燒杯 b.漏斗 c.玻璃棒 d.酒精燈
(3)固體成份是_________________(填名稱)。
(4)原料②的名稱為__________________。
Ⅱ.已知測定錳的一種方法是:錳離子轉化為高錳酸根離子,反應體系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—離子,有關離子反應方程式為:_______________________,用雙線橋標出上述反應的電子得失____________________________________。在錳離子轉化為高錳酸根離子的反應中,如果把反應后的溶液稀釋到1升,測得溶液的pH=2,則在反應中轉移電子的物質的量為_______mol。
【答案】 Cu2++Fe═Cu+Fe2+ abc Cu和Fe 稀硫酸 2Mn2++ 5 IO4—+ 3 H2O → 2 MnO4—+ 5 IO3—+ 6 H+ 略 1/60(或0.01)
【解析】Ⅰ.(1)根據題意知,該物質能和銅離子反應且不引進新的雜質離子,所以物質為鐵,鐵與銅離子反應的離子方程式為:Cu2++Fe═Cu+Fe2+;
(2)操作②的分離是固體、液體分離,所以應用過濾的方法,故用到的玻璃儀器有:a.燒杯b.漏斗c.玻璃棒,答案為:abc;
(3)操作①中加入過量的鐵才能使銅離子完全反應,所以所得固體的成分是鐵和銅,分離鐵和銅且回收銅,所以加入某物質與鐵反應,與銅不反應,且與鐵反應后的物質與操作①所得溶液中溶質的成分一樣,加入的原料②為稀硫酸;
Ⅱ.由于將錳離子轉化為高錳酸根離子,所以錳離子是還原劑失去電子,因此IO4—是氧化劑,其還原產物是IO3—,所以該離子反應方程式為2Mn2++ 5 IO4—+ 3 H2O → 2 MnO4—+ 5 IO3—+ 6 H+;在錳離子轉化為高錳酸根離子的反應2Mn2++ 5 IO4—+ 3 H2O → 2 MnO4—+ 5 IO3—+ 6 H+中,如果把反應后的溶液稀釋到1升,測得溶液的
pH = 2,則n(H+)=10-2mol/L×1L=0.01mol,在反應中轉移電子的物質的量為![]() mol=
mol=![]() mol。
mol。


 考前必練系列答案
考前必練系列答案科目:高中化學 來源: 題型:
【題目】實驗室制備1,2-二溴乙烷的反應原理如下:CH3CH2OH→CH2=CH2 CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反應有:乙醇在濃硫酸的存在下在140℃脫水生成乙醚。用少量的溴和足量的乙醇制備1,2-二溴乙烷的裝置如下圖所示:

有關數據列表如下:

回答下列問題:
(1)在此制備實驗中,要盡可能迅速地把反應溫度提高到170℃左右,其最主要目的是
______________;(填正確選項前的字母)
a.引發反應 b.加快反應速度
c.防止乙醇揮發 d.減少副產物乙醚生成
(2)在裝置C中應加入____,其目的是吸收反應中可能生成的酸性氣體;(填正確選項前的字母)
a.水 b.濃硫酸 c.氫氧化鈉溶液 d.飽和碳酸氫鈉溶液
(3)判斷該制備反應已經結束的最簡單方法是______________________;
(4)將1,2-二溴乙烷粗產品置于分液漏斗中加水,振蕩后靜置,產物應在____層(填“上”或“下”);
(5)連接有長玻璃導管的裝置B的作用是__________________;
(6)若產物中有少量副產物乙醚,可用__________________的方法除去;
(7)反應過程中應用冷水冷卻裝置D,其主要目的是__________________;但又不能過度冷卻(如用冰水),其原因是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數,下列敘述中正確的是 ( )
A. 常溫常壓下,11.2 LCO2所含的原子數為1.5NA
B. 常溫常壓下,48 g O3含有的氧原子數為3NA
C. 標準狀況下,224 L H2中所含原子數為NA
D. 標準狀況下,1 L水所含分子數為![]() NA
NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知在熱的堿性溶液中,NaClO發生如下反應:3NaClO![]() 2NaCl+NaClO3。在相同條件下NaClO2也能發生類似的反應,其最終產物是( )
2NaCl+NaClO3。在相同條件下NaClO2也能發生類似的反應,其最終產物是( )
A. NaCl、NaClO B. NaCl、NaClO3
C. NaClO、NaClO3 D. NaClO3、NaClO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【吉林大學附屬中學2017屆第八次模擬考試】麻黃素是中樞神經興奮劑,其合成路線如圖所示。NBS是一種選擇性溴代試劑。

已知:![]()
(1)其中A為烴,相對分子質量為92,A的結構簡式是________________;
E中官能團的名稱為___________________。
(2)反應B→C的反應條件和試劑是_______________,⑤的反應類型是________。
(3)F的結構簡式是____________________________。
(4)寫出C→D的化學方程式______________________________________。
(5)化合物F的芳香族同分異構體有多種,M和N是其中的兩類,它們的結構和性質如下:
①已知M遇FeCl3溶液發生顯色反應,能和銀氨溶液發生銀鏡反應,苯環上只有兩個對位取代基,則M的結構簡式可能為___________________________________。
②已知N分子中含有甲基,能發生水解反應,苯環上只有一個取代基,則N的結構有_____種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.(1)已知食鹽常加入KIO3來補充碘元素,檢驗食鹽中是否加碘,可利用如下反應:__KIO3+___KI+___H2SO4═___K2SO4+___I2+___H2O(配平反應方程式)
①利用上述反應檢驗食鹽中是否加碘,所需試劑是________(填下列選項的序號)
A、碘水B、KI溶液C、淀粉溶液D、稀硫酸E、AgNO3溶液
②如果反應中轉移0.2mol電子,則生成I2的物質的量為___________
(2)Cl2是一種有毒氣體,如果泄漏會造成嚴重的環境污染.化工廠可用濃氨水來檢驗Cl2是否泄漏,有關反應的化學方程式為:3Cl2(氣)+8NH3(氣)=6NH4Cl(固)+N2(氣)若反應中消耗Cl21.5mol則被氧化的NH3在標準狀況下的體積為__________L.
II.用98%的濃硫酸(其密度為1.84g/cm3)配制100mL1.0mol.L-1稀硫酸,
實驗步驟如下:①計算所用濃硫酸的體積②量取一定體積的濃硫酸③溶解④檢漏、轉移、洗滌⑤定容、搖勻。若實驗儀器有:A.100mL量筒 B.托盤天平C.玻璃棒D.50mL容量瓶 E.10mL量筒F.膠頭滴管G.50mL燒杯H.100mL容量瓶
回答下列問題:
(1)需量取濃硫酸的體積為___________mL.
(2)實驗時選用的儀器有___________(填序號)
(3)配制過程中,下列情況會使配制結果偏高的是___________(填序號)
①定容時俯視刻度線觀察液面
②容量瓶使用時未干燥
③定容后經振蕩、搖勻、靜置,發現液面低于刻度線,再加蒸餾水補至刻度線
④所用的濃硫酸長時間放置在密封不好的容器中⑤用量筒量取濃硫酸時仰視讀數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】偏二甲肼(C2H8N2)是一種高能液態燃料,其燃燒產生的巨大能量可作為航天運載火箭的推動力。下列敘述正確的是
A. NA個偏二甲肼分子的質量為60g
B. 標準狀況下,1mol偏二甲肼的體積約為22.4L
C. 偏二甲肼的摩爾質量為60g
D. 6g偏二甲肼分子中含有0.1NA個N2分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高氯酸銨(NH4ClO4)為白色晶體,具有不穩定性,在400 ℃時開始分解產生多種氣體,常用于生產火箭推進劑。某化學興趣小組同學利用下列裝置對NH4ClO4的分解產物進行探究。(假設裝置內藥品均足量,部分夾持裝置已省略。)
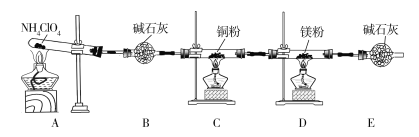
(1)在實驗過程中發現C中銅粉由紅色變為黑色,說明產物中有____________(填化學式)生成。
(2)實驗完畢后,取D中硬質玻璃管中的固體物質于試管中,滴加蒸餾水,產生能使濕潤的紅色石蕊試紙變藍色的氣體,產生該氣體的化學方程式為______________。
(3)通過上述實驗現象的分析,某同學認為產物中還應有H2O,可能有Cl2。該同學認為可能有Cl2存在的理由是_________________________________。
(4)為了證明H2O和Cl2的存在,選擇上述部分裝置和下列提供的裝置進行實驗:
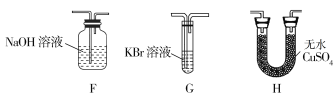
①按氣流從左至右,裝置的連接順序為A→________→________→________。
②實驗結束后發現G中液體變為橙黃色,用必要的文字和方程式解釋出現該現象的原因:________________________。
③F中發生反應的離子方程式為___________________________。
(5)實驗結論:NH4ClO4分解時產生了上述幾種物質,則高氯酸銨分解的化學方程式為________________________________________________。
(6)在實驗過程中儀器E中裝有堿石灰的目的是________________;實驗結束后,某同學擬通過稱量D中鎂粉質量的變化,計算高氯酸銨的分解率,會造成計算結果__________(填“偏大”“偏小”或“無法判斷”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】烏洛托品在合成、醫藥、染料等工業中有廣泛用途,其結構式如圖所示。將甲醛水溶液與氨水混合蒸發可制得烏洛托品。若原料完全反應生成烏洛托品,則甲醛與氨的物質的量之比為( )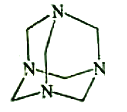
A. 1:1 B. 2:3 C. 3:2 D. 2:1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com