
【題目】(1)用電子式表示下列物質的形成過程:
①Na2S_________________; ②H2O________________
(2)寫出下列物質的電子式:
③ KOH__________ ④CO2_______________。
(3)下列物質:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。回答下列問題:(填序號)(每空2分,共10分)
只含極性鍵的是_______;含有極性鍵和非極性鍵的是_______;含有非極性鍵的離子化合物是_____。
【答案】 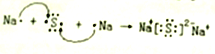
![]()
![]()
![]() ②③⑩ ⑧ ⑤
②③⑩ ⑧ ⑤
【解析】(1)①Na2S是離子化合物,其形成過程可表示為![]() ;②H2O是含有共價鍵的共價化合物,其形成過程可表示為
;②H2O是含有共價鍵的共價化合物,其形成過程可表示為![]() ;(2)③ KOH是離子化合物,電子式為
;(2)③ KOH是離子化合物,電子式為![]() ;④CO2是共價化合物,電子式為
;④CO2是共價化合物,電子式為![]() ;(3)①N2是含有非極性鍵的單質;②CO2是含有極性鍵的共價化合物;③NH3是含有極性鍵的共價化合物;④Na2O是含有離子鍵的離子化合物;⑤Na2O2是含有離子鍵和非極性鍵的離子化合物;⑥NaOH是含有離子鍵和極性鍵的離子化合物;⑦CaBr2是含有離子鍵的離子化合物;⑧H2O2是含有極性鍵和非極性鍵的共價化合物;⑨NH4Cl是含有離子鍵和極性鍵的離子化合物;⑩HBr是含有極性鍵的共價化合物,則只含極性鍵的是②③⑩;含有極性鍵和非極性鍵的是⑧;含有非極性鍵的離子化合物是⑤。
;(3)①N2是含有非極性鍵的單質;②CO2是含有極性鍵的共價化合物;③NH3是含有極性鍵的共價化合物;④Na2O是含有離子鍵的離子化合物;⑤Na2O2是含有離子鍵和非極性鍵的離子化合物;⑥NaOH是含有離子鍵和極性鍵的離子化合物;⑦CaBr2是含有離子鍵的離子化合物;⑧H2O2是含有極性鍵和非極性鍵的共價化合物;⑨NH4Cl是含有離子鍵和極性鍵的離子化合物;⑩HBr是含有極性鍵的共價化合物,則只含極性鍵的是②③⑩;含有極性鍵和非極性鍵的是⑧;含有非極性鍵的離子化合物是⑤。


 長江作業本同步練習冊系列答案
長江作業本同步練習冊系列答案科目:高中化學 來源: 題型:
【題目】銅是生物體必需的微量元素,也是人類最早使用的金屬之一。銅的生產和使用對國計民生各個方面都產生了深遠的影響。
(1)為了保護環境和節約資源,通常先用H2O2和稀硫酸的混合溶液溶出廢舊印刷電路板中的銅,最終實現銅的回收利用。寫出H2O2和稀硫酸的混合溶液與金屬銅反應的離子方程式:____________________________________。
(2)工業上以黃銅礦為原料,采用火法熔煉工藝生產銅。該工藝的中間過程會發生反應:2Cu2O+Cu2S![]() 6Cu+SO2↑,該反應的氧化劑是________;當生成19.2 g Cu 時,反應中轉移的電子為________ mol。
6Cu+SO2↑,該反應的氧化劑是________;當生成19.2 g Cu 時,反應中轉移的電子為________ mol。
(3)研究性學習小組用“間接碘量法”測定某試樣中CuSO4·5H2O(不含能與I-反應的氧化性雜質)的含量。稱取a g試樣配成 100 mL 溶液,取出25.00 mL溶液,向其中滴加 KI 溶液后有白色沉淀生成(發生的反應為2Cu2++4I-===2CuI↓+I2);繼續滴加 KI 溶液至沉淀不再產生,反應生成的 I2 與V mL c mol·L-1Na2S2O3溶液恰好完全反應(發生的反應為I2+2Na2S2O3===2NaI+Na2S4O6)。則試樣中CuSO4·5H2O的質量分數為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列與化學反應能量變化相關的敘述正確的是
A.生成物的總能量一定低于反應物的總能量
B.拆開物質中的化學鍵一定需要吸收能量
C.應用蓋斯定律,無法計算某些難以直接測量的反應焓變
D.化學反應都伴隨著能量和其他各種現象的出現
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分別在pH=1的酸和pH=14的NaOH溶液中加入足量的鋁,放出H2的量前者多,其原因可能是
①溶液的體積相同,酸是多元強酸
②兩溶液的體積相同,酸是一元弱酸
②酸溶液的體積大于NaOH溶液的體積
④酸是強酸,濃度比NaOH溶液的大
A.①② B.② C.②③ D.④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z三種短周期元素,原子半徑的大小關系為:r(y)>r(x)>r(z),原子序數之和為16。X、Y、Z三種元素的常見單質在適當條件下可發生下圖所示變化,其中B和C均為10電子分子。下列說法不正確的是
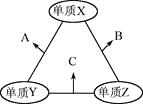
A. X元素位于ⅥA
B. A不能溶解于B中
C. B的沸點高于C的沸點
D. A和C不可能發生氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列食品化學知識的敘述正確的是
A. 新鮮蔬菜做熟后,所含維生素C會有損失
B. 油脂、淀粉、蛋白質均為可水解的高分子化合物
C. 纖維素在人體內可水解為葡萄糖,故可作人類的營養物質
D. 磨豆漿的大豆富含蛋白質,豆漿煮沸后蛋白質變成了氨基酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 二氧化氯可用于自來水的消毒 B. 氧化鎂可用于制造耐高溫材料
C. 把固體炸藥制成膠體能提高威力 D. 二氧化硫不可用于漂白紙漿
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g);ΔH <0的化學反應下列敘述不正確的是
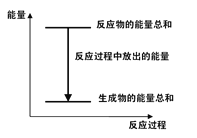
A.反應過程中能量關系可用如圖表示
B.若將該反應設計成原電池鋅為負極
C.ΔH的值與反應方程式的計量系數無關
D.若將其設計為原電池當有32.5g鋅溶解時,正極放出氣體一定為11.2L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com