
【題目】鉻、鐵、鈷、銅等金屬及其化合物在工業上有重要用途。請回答:
(1)基態鉻原子的價電子排布圖為___________。
(2)CrO2Cl2和NaClO均可作化工生產的氧化劑或氯化劑。制備CrO2Cl2的反應為K2Cr2O2+3CCl4=2KCl +2CrO2Cl2+3COCl2↑。
①上述反應式中非金屬元素電負性由大到小的順序是__________(用元素符號表示)。
②常溫時CrO2Cl2是一種易溶于CCl4的液體,則固態CrO2Cl2屬于__________晶體。
③配合物CrCl3·6H2O中心離子Cr3+的配位數為6,向含0.1molCrCl3·6H2O 的溶液中滴加2mol·L-1AgNO3溶液,反應完全后共消耗AgNO3溶液50mL,則配離子的化學式為___________。
(3)Co3+與NO2―形成的配合物與K+生成黃色沉淀檢驗溶液中的K+。配體NO2―的立體構型為__________,某常見氣體化合物為NO2―的等電子體,該化合物的分子式為__________。
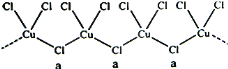
(4)氯和鉀與+2價的銅可生成一種催化乙炔聚合反應的化合物,其陰離子為無限長鏈結構(如下圖),a位置上Cl原子的雜化軌道類型為________雜化,這種化合物的化學式為_________
(5)鐵和氨氣在640 ℃可發生置換反應,產物之一的晶胞結構如圖所示,寫出該反應的化學方程式:_____。若兩個最近的Fe原子間的距離為a cm,則該晶體的密度是_____g/cm3(設阿伏加德羅常數的值為NA)。

【答案】![]() O>Cl>C 分子 [Cr(H2O)4Cl2]+ V形 SO2 sp3 KCuCl3 8Fe+3NH3
O>Cl>C 分子 [Cr(H2O)4Cl2]+ V形 SO2 sp3 KCuCl3 8Fe+3NH3![]() 2Fe4N+3H2
2Fe4N+3H2 ![]()
【解析】
(1)Cr是24號元素,其3d、4s電子為其價電子,3d、4s能級上分別含有5、1個電子,根據構造原理書寫基態鉻原子的價電子排布式,再寫出價電子排布圖;
(2)①同周期元素從左到右電負性逐漸增大,同主族元素從上到小電負性逐漸減小;
②分子晶體熔沸點較低;
③作為配體的Cl-則不能跟Ag+反應,可算出配體中Cl-數,再根據配位數為6寫出H2O分子中的配體數目;
(3)NO2-中N原子價層電子對個數=2+![]() =3,根據價層電子對互斥理論判斷N原子雜化類型,推斷其立體構型;與NO2-互為等電子體的微粒中含有3個原子、18個價電子;
=3,根據價層電子對互斥理論判斷N原子雜化類型,推斷其立體構型;與NO2-互為等電子體的微粒中含有3個原子、18個價電子;
(4)a位置上Cl原子成2個單鍵,含有2對孤對電子,雜化軌道數為4,根據價層電子對互斥理論判斷氯原子雜化方式;化合物中銅為+2價,Cu2+與Cl-形成的配合離子中Cl-數目為2+2×![]() =3,則陰離子構成為[CuCl3]-,根據各元素化合價的代數和為0確定化學式;
=3,則陰離子構成為[CuCl3]-,根據各元素化合價的代數和為0確定化學式;
(5)根據晶胞結構利用均攤法確定晶體的化學式。兩個最近的Fe原子間的距離為面心到頂點的距離,利用該距離求出晶胞邊長,從而求出晶胞體積,然后再計算密度。
(1)Cr是24號元素,其3d、4s電子為其價電子,3d、4s能級上分別含有5、1個電子,根據構造原理書寫基態鉻原子的價電子排布式為3d54s1,則價電子排布圖為![]() ;
;
(2)①反應式中非金屬元素有三種:O、C、Cl,CCl4中C表現正化合價、Cl表現負化合價,NaClO中Cl為+1價,O為-2價,電負性越大,對鍵合電子吸引力越大,元素相互化合時該元素表現負價,故電負性:O>Cl>C;
②分子晶體熔沸點較低,該物質的熔沸點較低,所以為分子晶體;
③經過計算Ag+物質的量0.1mol,說明該物質有0.1mol的Cl-不是配體,配體中Cl-為0.2mol,所以有2個Cl-為配體,因此H2O中有4個分子為配體,配離子的化學式為:[Cr(H2O)4Cl2]+;
(3)NO2-中N原子價層電子對個數=2+![]() =3,根據價層電子對互斥理論判斷N原子雜化類型為sp2,則配體NO2―的立體構型為V型;與NO2-互為等電子體的微粒中含有3個原子、18個價電子,與該離子互為等電子體的有SO2、O3等;
=3,根據價層電子對互斥理論判斷N原子雜化類型為sp2,則配體NO2―的立體構型為V型;與NO2-互為等電子體的微粒中含有3個原子、18個價電子,與該離子互為等電子體的有SO2、O3等;
(4)a位置上Cl原子成2個單鍵,含有2對孤對電子,雜化軌道數為4,根據價層電子對互斥理論判斷氯原子雜化軌道類型為sp3;化合物中銅為+2價,Cu2+與Cl-形成的配合離子中Cl-數目為2+2×![]() =3,則陰離子構成為[CuCl3]-,與K+組成的化合物化學式為KCuCl3;
=3,則陰離子構成為[CuCl3]-,與K+組成的化合物化學式為KCuCl3;
(5)根據晶胞結構,Fe原子位于頂點和面心,所含的原子的數目為8×![]() +6×
+6×![]() =4,N原子位于體心,共有1個,故化學式為Fe4N,由此可寫出該置換反應的化學方程式為8Fe+3NH3
=4,N原子位于體心,共有1個,故化學式為Fe4N,由此可寫出該置換反應的化學方程式為8Fe+3NH3![]() 2Fe4N+3H2;兩個最近的Fe原子間的距離為頂點到面心的距離,該距離為acm,則面對角線的距離為2acm,晶胞邊長為
2Fe4N+3H2;兩個最近的Fe原子間的距離為頂點到面心的距離,該距離為acm,則面對角線的距離為2acm,晶胞邊長為![]() acm,晶胞體積V=2
acm,晶胞體積V=2![]() a3cm.該晶胞的質量m=
a3cm.該晶胞的質量m=![]() M=
M=![]() ,故該晶胞的密度ρ=
,故該晶胞的密度ρ=![]() =
=![]() gcm3=
gcm3=![]() gcm3。
gcm3。


科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.標準狀況下,2.24 L乙醇中含有的氧原子數目為0.1NA
B.1 L 1mol/L的NaHCO3溶液中Na+、H+和CO32-的數目均為NA
C.16 g的O2和O3混合氣體中所含原子總數為NA
D.18 g水中所含電子總數為8NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水氯化鋅常用作有機合成的催化劑。實驗室采用HCl氣體除水、ZnCl2升華相結合的方法提純市售氯化鋅樣品(部分潮解并含高純高溫不分解雜質)。實驗裝置如圖所示:
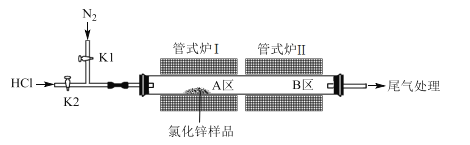
回答下列問題:
(1)無水氯化鋅在空氣中易潮解生成Zn(OH)Cl的化學方程式為_____。
(2)除水階段:打開K1,K2。將管式爐I、II升溫至150 ℃,反應一段時間后將管式爐I、II的溫度升至350 ℃,保證將水除盡。除水階段發生反應的化學方程式為 ____。
(3)升華階段:撤去管式爐II,將管式爐I迅速升溫至750℃,升溫的目的是_____。一段時間后關閉管式爐I并關閉 ____(填K1或K2),待冷卻后關閉 ____(填K1或K2)。最后將_____(填A或B)區的氯化鋅轉移、保存。
(4)除水階段HCl與 N2流速要快,有利于提高除水效率。升華階段HCl與N2流速要慢,其原因是_____。
(5)測定市售ZnCl2樣品中的鋅的質量分數。步驟如下:
① 溶液配制:稱取m g樣品,加水和鹽酸至樣品溶解,轉移至250 mL的 ____中,加蒸餾水至刻度線,搖勻。
② 滴定:取25.00mL待測液于錐形瓶中,用c mol·L-1K4[Fe(CN)6]標準溶液滴定至終點,消耗V mL。滴定反應為:2K4[Fe(CN)6]+3ZnCl2=K2Zn3[Fe(CN)6]2↓+6KCl該樣品中鋅的質量分數為 ____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗原理或操作正確的是

A. 選擇合適的試劑,用圖甲可分別制取少量CO2、CO和SO2
B. 洗滌沉淀時(見圖乙),向漏斗中加入適量水至浸沒沉淀并濾干,重復2-3次
C. 用圖丙所示裝置除去HCl中的少量CO2
D. 用圖丁裝置從KI和I2的固體混合物中回收I2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在溫度相同、容積均為2 L的3個恒容密閉容器中,按不同方式投入反應物,保持恒溫,測得反應達到平衡時的有關數據如下。下列說法正確的是
容器 | 甲 | 乙 | 丙 |
反應物投入量 | 1mo N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3濃度(mol/L) | c1 | c2 | c3 |
反應的能量變化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
體系壓強(Pa) | p1 | p2 | p3 |
反應物轉化率 | α1 | α2 | α3 |
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
A. 2p1=2p3<p2 B. 達到平衡時丙容器中NH3的體積分數最大
C. α2+α3<1 D. Q1+Q3=92.4
查看答案和解析>>
科目:高中化學 來源: 題型:
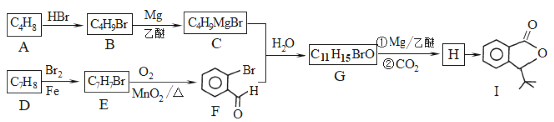
【題目】化合物I是一種抗腦缺血藥物,合成路線如下:
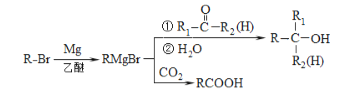
已知:
回答下列問題:
(1)按照系統命名法,A的名稱是_____;寫出A發生加聚反應的化學方程式:__________。
(2)反應H→I的化學方程式為________;反應E→F的反應類型是______。
(3)寫出符合下列條件的G的所有同分異構體的結構簡式:________
①遇FeCl3溶液發生顯色反應 ②核磁共振氫譜有4組峰
(4)α,α-二甲基芐醇(![]() )是合成醫藥、農藥的中間體,以苯和2-氯丙烷為起始原料制備α,α-二甲基芐醇的合成路線如下:
)是合成醫藥、農藥的中間體,以苯和2-氯丙烷為起始原料制備α,α-二甲基芐醇的合成路線如下:
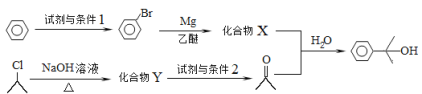
該合成路線中X的結構簡式為____,Y的結構簡式為________;試劑與條件2為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如表實驗操作、現象與結論對應關系正確的是
選項 | 實驗操作 | 實驗現象 | 結論 |
A | 相同溫度下,同時向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分別加入4mL1mol·L-1H2C2O4溶液 | ①中溶液先褪色 | 該實驗條件下,KMnO4濃度越小,反應速率越快 |
B | 向煤爐中灼熱的煤炭上灑少量水 | 產生淡藍色火焰,煤炭燃燒更旺 | 加少量水后,可使煤炭燃燒放出更多的熱量 |
C | 將苯、液溴和鐵粉混合后,將產生的氣體先通入CCl4,再通入水中,測所得水溶液的pH | pH<7 | 證明苯與液溴發生的是取代反應 |
D | 分別測定室溫下等物質的量濃度的Na2SO3與Na2CO3溶液的pH | 后者較大 | 證明非金屬性 S>C |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】觀察下列A、B、C、D、E五種粒子(原子或離子)的結構示意圖、下列說法不正確的是
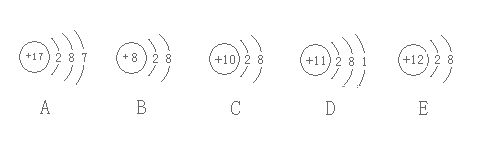
A.B、C、E三種微粒均為穩定結構
B.A與D、B與E均可以形成微粒比為1:1的化合物
C.在0.5mol/LDAB溶液中滴加適量稀鹽酸不能增強溶液的漂白能力
D.A與B可以形成A2B7的化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮氧化物(NOx)是大氣污染物之一。工業上在一定的溫度和催化劑條件下,可用NH3來消除NOx的污染,生成兩種對環境無害的物質。
(1)請寫出NH3與NO2反應的化學方程式____。
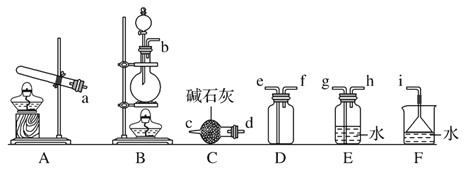
(2)①寫出實驗室中由固體物質制取氨氣的化學方程式__;
②欲收集一瓶干燥的氨氣,選擇下圖中的裝置,其連接順序為:發生裝置→____(按氣流方向,用小寫字母表示)
(3)電解法處理含氮氧化物廢氣,可回收硝酸,具有較高的環境效益和經濟效益。實驗室模擬電解法吸收NOx的裝置如圖所示(圖中電極均為石墨電極)。若用NO2氣體進行模擬電解法吸收實驗。
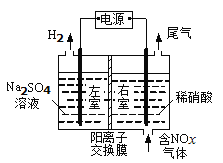
①寫出電解時NO2發生反應的電極反應式:___。
②若有標準狀況下2.24LNO2被吸收,通過陽離子交換膜(只允許陽離子通過)的H+為__mol。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com