
【題目】利用下列裝置可以制備無水氯化鐵。下列有關說法不正確的是( )
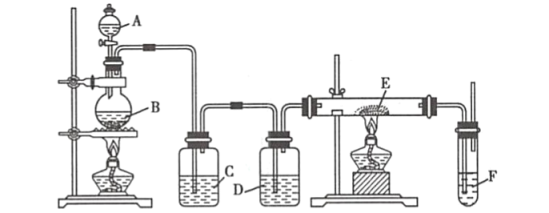
A.燒瓶B中制備氯氣的反應物為二氧化錳和濃鹽酸
B.裝置C、D中分別盛有飽和食鹽水和濃硫酸
C.裝置D和裝置E之間需要增加一個干燥裝置,才能制得無水氯化鐵
D.裝置F的目的是吸收尾氣
【答案】C
【解析】
由裝置圖可知圓底燒瓶中發生的是實驗室制備氯氣的反應,C中呈放的是飽和食鹽水,吸收反應是揮發出的HCl,D中盛放的是濃硫酸,用于干燥氯氣,E中放置的是鐵粉,在雙通管中生成無水氯化鐵。
A. 實驗室制備氯氣用二氧化錳和濃鹽酸,因此燒瓶B中制備氯氣的反應物為二氧化錳和濃鹽酸,A項正確,不符合題意;
B. C中呈放的是飽和食鹽水,吸收反應時揮發出的HCl,D中盛放的是濃硫酸,用于干燥氯氣,B項正確,不符合題意;
C. 裝置E和裝置F之間需要增加一個干燥裝置,才能制得無水氯化鐵,C項錯誤,符合題意;
D. 氯氣是大氣污染物,因此裝置F的目的是吸收反應中多余的氯氣防止污染空氣,D項正確;
答案選C。


科目:高中化學 來源: 題型:
【題目】合理應用和處理氮的化合物,在生產生活中有重要意義。
(1)尿素[CO(NH2)2]是一種高效化肥,也是一種化工原料。
①以尿素為原料在一定條件下發生反應:
CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g)△H=+133.6 kJ/mol。關于該反應的下列說法正確的是______(填序號)。
2NH3(g)+CO2(g)△H=+133.6 kJ/mol。關于該反應的下列說法正確的是______(填序號)。
a.從反應開始到平衡時容器中混合氣體的平均相對分子質量保持不變
b.在平衡體系中增加水的用量可使該反應的平衡常數增大
c.降低溫度可使尿素的轉化率增大
d. 達到平衡后,縮小容器的體積,平衡向逆反應方向移動,達新平衡時NH3的濃度大于原平衡
②尿素在一定條件下可將氮的氧化物還原為氮氣。
已知:
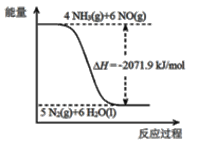
再結合①中的信息,則反應2CO(NH2)2(s)+6NO(g)![]() 5N2(g)+2CO2(g)+4H2O(l)的△H =_______kJ/mol。
5N2(g)+2CO2(g)+4H2O(l)的△H =_______kJ/mol。
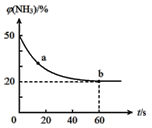
③密閉容器中以等物質的量的NH3和CO2為原料,在120℃、催化劑作用下反應生成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g),混合氣體中NH3的物質的量百分含量隨時間變化關系如圖所示,氨氣的平衡轉化率為________________。
CO(NH2)2(s)+H2O(g),混合氣體中NH3的物質的量百分含量隨時間變化關系如圖所示,氨氣的平衡轉化率為________________。
(2)NO2會污染環境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2g NO2和Na2CO3溶液完全反應時轉移電子0.1mol,恰好反應后,使溶液中的CO2完全逸出,所得溶液呈弱堿性,則溶液中離子濃度大小關系是c(Na+)>______。
(3)用肼燃料電池為電源,通過離子交換膜電解法控制電解液中OH-的濃度來制備納米Cu2O,裝置如圖所示:
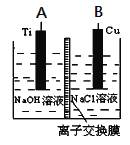
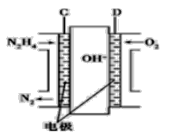
上述裝置中陽極反應式為________________________,該電解池中的離子交換膜為________(填“陰”或“陽”)離子交換膜。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋植物如海帶、海藻中含有豐富的碘元素,碘元素以碘離子的形式存在。實驗室里從海藻中提取碘的流程如下(已知2KI+Cl2=2KCl+I2,碘與溴一樣易溶于有機溶劑):
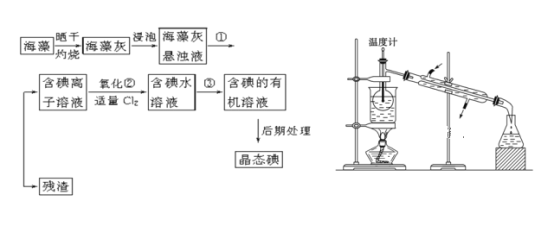
(1)指出提取碘的過程中有關的實驗操作名稱:①________,③________。
(2)提取碘的過程中,可供選擇的有機試劑是________。
A 苯 B 四氯化碳 C 酒精 D 醋酸
(3)為使上述流程中含碘離子溶液轉化為碘的有機溶液,實驗室里有燒杯、玻璃棒以及必要的夾持儀器,尚缺少的玻璃儀器是___________。
(4)從含碘的有機溶液中提取碘和回收有機溶劑,還需經過蒸餾,指出上圖所示實驗裝置中的錯誤之處:
①__________。②_____________。③_________。
(5)進行上述蒸餾操作時使用水浴的原因是__________。
(6)如果本實驗用苯做萃取劑,則上層液體的顏色為_______色,下層液體中溶質的主要成分為___________(寫化學式)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組的同學向一定體積的Ba(OH)2溶液中逐漸加入稀硫酸,并測得混合溶液的導電能力隨時間變化的曲線如圖所示。該小組的同學關于如圖的下列說法中,不正確的是( )
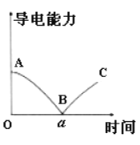
A.AB段溶液的導電能力不斷減弱,說明生成的BaSO4不是電解質
B.B處溶液的導電能力約為0,說明溶液中幾乎沒有自由移動的離子
C.BC段溶液的導電能力不斷增大,主要是由于過量的H2SO4電離出的離子導電
D.a時刻Ba(OH)2溶液與稀硫酸恰好完全中和
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳氧化物的轉化有重大用途,回答關于CO和![]() 的問題。
的問題。
![]() 已知:
已知:![]()
![]()
![]()
則![]() 的
的![]() ______
______![]() 用
用![]() 、
、![]() 、
、![]() 表示
表示![]() 。
。
![]() 對于化學平衡
對于化學平衡![]() ,在不同溫度下,CO的濃度與反應時間的關系如圖所示,由圖可得出如下規律:
,在不同溫度下,CO的濃度與反應時間的關系如圖所示,由圖可得出如下規律:
隨著溫度升高,______、______

![]() 某溫度下,將
某溫度下,將![]()
![]() 和足量碳充入3L的恒容密閉容器中,發生如下反應:
和足量碳充入3L的恒容密閉容器中,發生如下反應:![]() ,達到平衡時測得
,達到平衡時測得![]() 為平衡常數
為平衡常數![]() ,求平衡時
,求平衡時![]() 的轉化率___________?
的轉化率___________?![]() 寫出計算過程
寫出計算過程![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,電解質溶液的性質與變化是多樣的,下列說法正確的是( )
A. pH相同的①CH3COONa ②NaClO ③NaOH三種溶液c(Na+)大小:①>②>③
B. 往稀氨水中加水,![]() 的值變小
的值變小
C. pH=4的H2S溶液與pH=10的NaOH溶液等體積混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—)
D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液堿性增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 1mol任何氣體的體積都是22.4L
B. 同溫同壓下兩種氣體,只要它們的分子數相同,所占體積也一定相同
C. 在標準狀況下,體積為22.4L的物質都是1mol
D. 在非標準狀況下,1mol任何氣體的體積不可能是22.4L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列敘述正確的是( )
A.23 g鈉的原子最外層電子數為2NAB.1 L 0.1 mol·L-1乙酸溶液中H+數為0.1NA
C.標準狀況下,22.4 L乙烷的分子數為NAD.1 mol羥基所含電子數為10NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E是高中階段學習的五種物質,單質A在單質B中燃燒產生蒼白色的火焰,產物溶于水得到常見的強酸。化合物C、D是剛學過的兩種有重要用途的物質,化合物C具有強氧化性、漂白性,是單質B與水反應的產物之一。化合物D是淡黃色物質,可用于呼吸面具,可由E與氧氣燃燒得到。回答下列問題:
(1)化學式A: ________;B:________;C:________;D:________;E:________;
(2)單質A與單質B反應的化學方程式: _______________。
(3)E與氧氣燃燒反應的化學方程式: _________________。
(4)D用于呼吸面具中,發生反應的化學方程式: ____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com