
【題目】CO2催化重整CH4的反應:(Ⅰ)CH4(g)+CO2(g)![]() 2CO(g)+2H2(g);ΔH1,
2CO(g)+2H2(g);ΔH1,
主要副反應:(Ⅱ)H2(g)+CO2(g)![]() CO(g)+H2O(g);ΔH2>0,
CO(g)+H2O(g);ΔH2>0,
(Ⅲ)4H2(g)+CO2(g)![]() CH4(g)+2H2O(g);ΔH3<0。
CH4(g)+2H2O(g);ΔH3<0。
在恒容反應器中按體積分數V(CH4)∶V(CO2)=50%∶50%充入氣體,加入催化劑,測得反應器中平衡時各物質的體積分數與溫度的關系如圖所示。下列說法正確的是( )
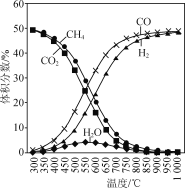
A.ΔH1=2ΔH2-ΔH3<0
B.其他條件不變,適當增大起始時V(CH4)∶V(CO2),可抑制副反應(Ⅱ)、(Ⅲ)的進行
C.300~580℃時,H2O的體積分數不斷增大,是由于反應(Ⅲ)生成H2O的量大于反應(Ⅱ)消耗的量
D.T℃時,在2.0L容器中加入2mol CH4、2mol CO2以及催化劑進行重整反應,測得CO2的平衡轉化率為75%,則反應(Ⅰ)的平衡常數小于81
【答案】BD
【解析】
A. 反應(Ⅰ)可由2倍(Ⅱ)減去反應(Ⅲ)得到,故ΔH1=2ΔH2-ΔH3,再根據圖示,隨溫度的升高,CH4和CO2的體積分數減小,說明升溫,平衡正移,而升溫平衡向吸熱方向移,正反應吸熱,ΔH1>0,A不正確;
B. 其他條件不變,適當增大起始時V(CH4)∶V(CO2),即增大CH4濃度和減小CO2濃度,根據平衡移動原理,減小反應物濃度或增加生成物濃度,平衡都逆向移動,B正確;
C. 300~580℃時,H2O的體積分數不斷增大,反應(Ⅲ)是放熱反應,升溫時,平衡逆移消耗H2O,反應(Ⅱ)是吸熱反應,升溫時正移,生成H2O,而由于反應(Ⅲ)消耗H2O的量小于反應(Ⅱ)生成水的量,C錯誤;
D. T℃時,在2.0L容器中加入2mol CH4、2mol CO2以及催化劑進行重整反應,測得CO2的平衡轉化率為75%,則CO2轉化的濃度為![]() 根據三段式:
根據三段式:
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起 1mol/L 1mol/L 0 0
轉0.75mol/L 0.75mol/L 1.5mol/L 1.5mol/L
平 0.25mol/L 0.25mol/L 1.5mol/L 1.5mol/L
若不考慮副反應,則反應(Ⅰ)的平衡常數![]() ,但由于副反應(Ⅲ)中,消耗的氫氣的量比二氧化碳多的多,故計算式中,分子減小的更多,值小于81,D正確;
,但由于副反應(Ⅲ)中,消耗的氫氣的量比二氧化碳多的多,故計算式中,分子減小的更多,值小于81,D正確;
答案選BD。


科目:高中化學 來源: 題型:
【題目】一定溫度下,某密閉恒容的容器內可逆反應A(g)+3B(g)![]() 2C(g)達到平衡狀態的標志
2C(g)達到平衡狀態的標志
A. A的消耗速率是C的分解速率1/2倍
B. 容器內混合氣體的密度不隨時間而變化
C. 單位時間內生成nmolA,同時生成3nmolB
D. A、B、C的分子數之比為1:3:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向mg鎂和鋁的混合物中加入適量的稀硫酸,恰好完全反應生成標準狀況下的氣體bL。向反應后的溶液中加入cmol/L氫氧化鉀溶液VmL,使金屬離子剛好沉淀完全,得到的沉淀質量為ng。再將得到的沉淀灼燒至質量不再改變為止,得到固體pg。則下列關系不正確的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在給定條件下,下列選項所示的物質間轉化均能實現的是( )
A.MgCl2(熔融)![]() Mg(s)
Mg(s)![]() MgO(s)
MgO(s)
B.CaC2(s)![]() C2H4(g)
C2H4(g)![]()
![]()
C.FeS2(s)![]() SO2(g)
SO2(g)![]() (NH4)2SO4(aq)
(NH4)2SO4(aq)
D.Al(OH)3(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() AlCl3(aq)
AlCl3(aq)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某物質由鐵和氧兩種元素組成,實驗測得鐵元素與氧元素的質量比為21∶8,關于該物質的下列說法中不正確的是( )
A.鐵元素與氧元素物質的量比為3∶4
B.該物質可能為四氧化三鐵
C.該物質一定為四氧化三鐵
D.該物質可能為混合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將1mol的CuSO4·5H2O(s)溶于水會使溶液溫度降低,熱效應為△H1,將1mol的CuSO4(s)溶于水會使溶液溫度升高,熱效應為△H2;CuSO4·5H2O受熱分解的化學方程式為:CuSO4·5H2O(s)△CuSO4(s)+5H2O(l), 熱效應為△H3。則下列判斷正確的是
A. △H2>△H3 B. △H1<△H3
C. △H1+△H3=△H2 D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaClO廣泛用作消殺劑、水處理劑及漂白劑等。
已知:NaClO溶液中物種分布分數與溶液pH的關系如圖1所示。
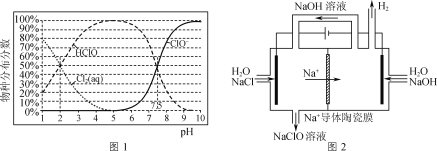
(1)向NaClO溶液中通入CO2,發生反應的離子方程式為___(H2CO3的lgKa1、lgKa2依次為-6.38、-10.21);反應ClO-+H2O![]() HClO+OH-的lgK=____。
HClO+OH-的lgK=____。
(2)用Na+導體陶瓷膜電解法生產次氯酸鈉溶液的裝置如圖2所示。
①陽極產生Cl2的電極反應式為____。
②其他條件不變,若撤去“Na+導體陶瓷膜”,NaClO的產率則會降低,其主要原因是___。
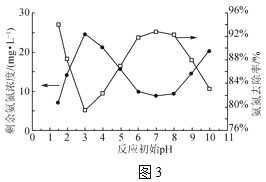
(3)NaClO溶液中ClO-與H2O產生更強氧化性的HClO,可將水體中氨氮氧化為N2(NH3比NH![]() 更易被氧化)。室溫時,取氨氮廢水200mL,在轉速、NaClO投加量相同且均反應30min時,反應初始pH對剩余氨氮濃度及氨氮去除率的影響如圖3所示。
更易被氧化)。室溫時,取氨氮廢水200mL,在轉速、NaClO投加量相同且均反應30min時,反應初始pH對剩余氨氮濃度及氨氮去除率的影響如圖3所示。
①NaClO氧化NH3的化學方程式為___。
②pH在3~7時,隨pH增大氨氮去除率升高的原因是___。
③pH在7~9時,隨pH增大氨氮去除率降低的原因是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應N2O4![]() 2NO2在溫度一定時,平衡體系中NO2的體積分數V(NO2)%隨壓強的變化情況如圖所示。下列說法正確的是
2NO2在溫度一定時,平衡體系中NO2的體積分數V(NO2)%隨壓強的變化情況如圖所示。下列說法正確的是
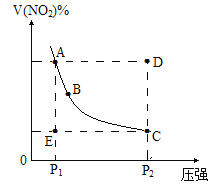
A.A、C兩點的正反應速率的關系![]()
B.A、B、C、D、E各狀態,![]() 的是狀態E
的是狀態E
C.維持![]() 不變,
不變,![]() 所需時間為x,維持
所需時間為x,維持![]() 不變,
不變,![]() 所需時間為y,則
所需時間為y,則![]()
D.使E狀態從水平方向到達C狀態,從理論上來講,可選用的條件是從![]() 突然加壓至
突然加壓至![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機化合物的結構簡式如圖所示。有關該化合物的敘述不正確的是( )
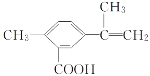
A.該有機物的分子式為C11H12O2
B.1mol該物質最多能與4molH2發生加成反應
C.該有機物在一定條件下,可以發生取代、氧化、酯化反應
D.該有機物與鈉反應不如水與鈉反應劇烈
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com