
【題目】原子序數依次增大的短周期主族元素X、Y、Z、W、R,其中X、Y兩種元素的核電荷數之差等于它們的原子最外層電子數之和;Y、Z位于相鄰主族;Z是地殼中含量最高的元素;X、W是同主族元素。上述五種元素兩兩間能形成四種常見的化合物甲、乙、丙、丁,這四種化合物中原子個數比如下表:
甲 | 乙 | 丙 | 丁 | |
化合物中各元素原子個數比 |
|
|
|
|
(1)寫出下列元素符號:Y_____________,Z_______________,W_____________,R________________。
(2)寫出下列化合物的電子式:乙_______________,丙__________________。
(3)向甲的水溶液中加入丁,有淡黃色沉淀生成,請寫出反應的化學方程式:__________________。
(4)甲和乙反應能放出大量的熱,同時生成兩種無污染的物質,請寫出該反應的化學方程式:______________________________。
【答案】N O Na S 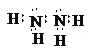
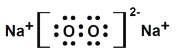 H2O2+Na2S=2NaOH+S↓ N2H4+2H2O2=N2+4H2O
H2O2+Na2S=2NaOH+S↓ N2H4+2H2O2=N2+4H2O
【解析】
根據題目,X、Y、Z、W、R五種短周期元素,原子序數依次遞增,Z為地殼中含量最多的元素,故Z為O元素;Y、Z位于相鄰主族,則Y為N元素;X、Y兩種元素的核電荷數之差等于它們的原子最外層電子數之和,設X元素的原子序數為x,則該原子的最外層電子數為x或x-2,當最外層電子數為x時,根據題目x+5=7-x,解得x=1,當最外層電子數為x-2時,根據題目,x-2+5=7-x,x=2,但題目要求X為主族元素,故X元素為H元素;X、W是同主族元素,則W為Na元素;根據表格,H和O兩種元素形成原子個數比為1:1的化合物,則甲為H2O2,N和H兩種元素形成原子個數比為1:2的化合物,則乙為N2H4,Na和O兩種元素形成原子個數比為1:1的化合物,則丙為Na2O2,Na和R元素形成原子個數比為2:1的化合物,可以推斷該化合物為Na2S,則R元素為S元素,據此答題。
(1)Y的元素符號為N,Z的元素符號為O,W的元素符號為Na,R的元素符號為S;
(2)乙物質的電子式為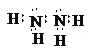 ,丙物質的電子式為
,丙物質的電子式為 ;
;
(3)向過氧化氫溶液中加入硫化鈉,出現淡黃色沉淀,該沉淀為S沉淀,反應方程式為:H2O2+Na2S=2NaOH+S↓;
(4)過氧化氫和N2H4發生反應生成兩種無污染的物質,這兩種物質為N2和H2O,則反應方程式為:N2H4+2H2O2=N2+4H2O。


 名題金卷系列答案
名題金卷系列答案 優加精卷系列答案
優加精卷系列答案科目:高中化學 來源: 題型:
【題目】等體積、等物質的量濃度的硫酸、氫氧化鈉溶液分別放在甲、乙兩燒杯中,各加入等質量的鋁,生成氫氣的體積比為5:6,則甲、乙兩燒杯中的反應情況可能分別是
A. 甲、乙中都是鋁過量 B. 甲中鋁過量,乙中堿過量
C. 甲中酸過量,乙中鋁過量 D. 甲中酸過量,乙中堿過量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨是人類科技發展史上的一項重大突破。已知25℃時,合成氨反應的熱化學方程式為N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ/mol。請回答下列問題:
2NH3(g) △H=-92.4 kJ/mol。請回答下列問題:
(1)保持容器溫度不變,縮小容器體積,化學反應速率_______(填“增大”或“減小”)。
(2)25℃時,取一定量的N2和H2于2 L的密閉容器中在催化劑存在下進行反應達到平衡,若增大N2的濃度,則H2的轉化率____(填“增大”或“減小”);若反應達到平衡時放出的熱量是92.4 kJ,則生成的NH3為______________mol。
(3)恒溫恒容條件下,上述反應達到化學平衡狀態的標志是________(填字母代號)。
A. N2、H2、NH3的濃度相等
B.容器內壓強不再變化
C.單位時間內消耗a mol N2,同時生成2a mol NH3
(4)上述反應平衡常數的表達式為K=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數值。下列有關敘述正確的是( )
A. 14 g乙烯和丙烯混合氣體中的氫原子數為2NA
B. 1 mol N2與4 mol H2反應生成的NH3分子數為2NA
C. 1 mol Fe溶于過量硝酸,電子轉移數為2NA
D. 標準狀況下,2.24 L CCl4含有的共價鍵數為0.4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金剛烷是一種重要的化工原料,工業上可通過下列途徑制備:

請回答下列問題:
(1)環戊二烯分子中最多有__________個原子共面;
(2)金剛烷的分子式為____________________,其分子中的CH2基團有__________個;
(3)下面是以環戊烷為原料制備環戊二烯的合成路線:
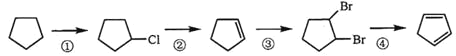
其中,反應①的產物名稱是_____________,反應②的反應試劑和反應條件是_________,反應③的反應類型是_____________;
(4)已知烯烴能發生如下的反應:  ,請寫出下列反應產物的結構簡式:
,請寫出下列反應產物的結構簡式: ___________。
___________。
(5)A是二聚環戊二烯的同分異構體,能使溴的四氯化碳溶液褪色,A經高錳酸鉀酸性溶液加熱氧化可以得到對苯二甲酸[提示:苯環的烷基(—CH3,—CH2R,—CHR2)或烯基側鏈經酸性高錳酸鉀溶液氧化得羧基],寫出A的一種結構簡式(不考慮立體異構):________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A. 飽和Na2CO3溶液與CaSO4固體反應:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO堿性溶液與Fe(OH)3反應:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 電解飽和食鹽水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以葡萄糖為原料制得的山梨醇(A)和異山梨醇(B)都是重要的生物質轉化平臺化合物。E是一種治療心絞痛的藥物,由葡萄糖為原料合成E的過程如下:

回答下列問題:
(1)葡萄糖的分子式為__________。
(2)A中含有的官能團的名稱為__________。
(3)由B到C的反應類型為__________。
(4)C的結構簡式為__________。
(5)由D到E的反應方程式為______________。
(6)F是B的同分異構體,7.30 g的F與足量飽和碳酸氫鈉反應可釋放出2.24 L二氧化碳(標準狀況),F的可能結構共有________種(不考慮立體異構),其中核磁共振氫譜為三組峰,峰面積比為3∶1∶1的結構簡式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下圖所示裝置進行下列實驗,其中丙中實驗現象描述正確的是

實驗 | 試劑甲 | 試劑乙 | 試劑丙 | 丙中的現象 |
A | 濃硫酸 | 亞硫酸鈉 | 紫色石蕊試液 | 溶液先變紅后褪色 |
B | 濃鹽酸 | 高錳酸鉀 | 淀粉碘化鉀溶液 | 溶液會變藍 |
C | 稀鹽酸 | 碳酸鈣 | 氯化鋇溶液 | 有白色沉淀生成 |
D | 濃氨水 | 氧化鈣 | 氯化鋁溶液 | 先生成白色沉淀然后沉淀溶解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KI溶液在酸性條件下能與氧氣反應。現有以下實驗記錄:
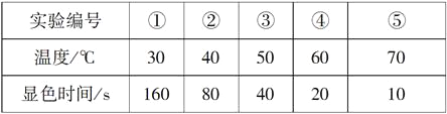
回答下列問題:
(1)該反應的離子方程式為_____________________________________。
(2)該實驗的目的是__________________________________。
(3)實驗試劑除了1 mol·L-1KI溶液、0.1 mol·L-1H2SO4溶液外,還需要的試劑是________,實驗現象為_____________________________。
(4)上述實驗操作中除了需要(3)的條件外,還必須控制不變的是________(填字母)。
A.溫度
B.試劑的濃度
C.試劑的用量(體積)
D.試劑添加的順序
(5)由上述實驗記錄可得出的結論是_________________________。
(6)若要進行溶液酸性大小對反應速率的影響的探究實驗,你會采取的措施是_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com