
【題目】[化學——選修3:物質結構與性質]某綠色農藥結構簡式為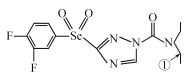 ,回答下列問題。
,回答下列問題。
(1)N元素的基態原子核外有_____種空間運動狀態的電子,該農藥組成元素中,第一電離能較大的前三種元素是(按由大到小順序排列)__________________(用元素符號回答,下同),基態硒原子的價層電子排布式為________________________。
(2)該物質中雜化軌道類型為sp2的原子有__________,分子內,分子中編號為①的碳原子和與其成鍵另外幾個原子構成的空間結構為_____________。
(3)碳、氫、氧元素可形成一系列的化合物,如CH4、C2H6、CH3OH等。三種物質的沸點高低順序為CH4<C2H6<CH3OH,其原因是_______________________________________,三種物質中屬于極性分子的物質是__________,與CH4互為等電子體的一種微粒是______。
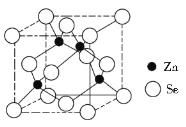
(4)硒化鋅的晶胞結構如圖所示,則硒的配位數為_______,若晶胞邊長為d pm,設阿伏加德羅常數的值為NA,則硒化鋅的密度為____________(不必化簡)。
【答案】(1)5(1分) F>N>O (2分) 4s24p4(1分)
(2)N、C (2分) 四面體(2分)
(3)乙烷的分子間力比甲烷的大,甲醇可形成分子間氫鍵而乙烷不能(2分) CH3OH(1分) ![]() (1分)
(1分)
(4)4(1分) ![]() g/cm3(2分)
g/cm3(2分)
【解析】(1)基態氮原子的電子占據5個原子軌道,故有5種不同空間運動狀態的電子。由周期表中第一電離能遞變規律及N原子的3p能層電子處于半充滿狀態知,第一電離能較大的前三種元素分別是F、N、O。
(2) 由結構簡式知,分子中有形成3個σ鍵、1個π鍵的碳原子、有形成2個σ鍵、1個π鍵還有一個孤電子對的氮原子,故雜化軌道類型為sp2的有氮原子,碳原子。①號碳原子形成了四個σ鍵,故為四面體結構。
(3)三種物質均是分子晶體,乙烷相對分子質量比CH4的大,分子間作用力比甲烷的大。乙烷與甲醇相對分子質量相差很小,甲醇可形成分子間氫鍵而乙烷不能,故甲醇沸點高于乙烷。甲烷和乙烷屬于非極性分子,甲醇屬于極性分子。與CH4互為等電子體的一種微粒為![]() 。
。
(4)觀察硒化鋅的晶胞結構知,硒、鋅原子的配位數均是4個。一個晶胞中含有4個“ZnSe”結構單元,其質量m=![]() ×144=
×144=![]() g,晶胞的體積為(d×10-10 cm)3,密度為
g,晶胞的體積為(d×10-10 cm)3,密度為![]() g/cm3。
g/cm3。


 出彩同步大試卷系列答案
出彩同步大試卷系列答案科目:高中化學 來源: 題型:
【題目】固體氧化物燃料電池是由美國西屋(Westinghouse)公司研制開發的。它以固體氧化鋯—氧化釔為電解質,這種固體電解質在高溫下允許氧離子(O2-)在其間通過。該電池的工作原理如下圖所示,其中多孔電極a、b均不參與電極反應。下列判斷正確的是

A. 有O2放電的a極為電池的負極
B. O2-移向電池的正極
C. b極對應的電極反應為2H2-4e-+2O2-=2H2O
D. a極對應的電極反應為O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】己二酸 是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如下:
是一種工業上具有重要意義的有機二元酸,在化工生產、有機合成工業、醫藥、潤滑劑制造等方面都有重要作用,能夠發生成鹽反應、酯化反應等,并能與二元醇縮聚成高分子聚合物等,己二酸產量居所有二元羧酸中的第二位.實驗室合成己二酸的反應原理和實驗裝置示意圖如下:
![]()

可能用到的有關數據如下:
物質 | 密度(20℃) | 熔點 | 沸點 | 溶解性 | 相對分子質量 |
環己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃時水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃時,1.44g,25℃時2.3g,易溶于乙醇,不溶于苯 | 146 |
實驗步驟如下:
I、在三口燒瓶中加入16mL50%的硝酸(密度為1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL環己醇。
Ⅱ、水浴加熱三口燒瓶至50℃左右,移去水浴,緩慢滴加5~6滴環己醇,搖動三口燒瓶,觀察到有紅棕色氣體放出時再慢慢滴加剩下的環己醇,維持反應溫度在60℃~65℃之間。
Ⅲ、當環己醇全部加入后,將混合物用80℃~90℃水浴加熱約10min(注意控制溫度),直至無紅棕色氣體生成為止。
IV、趁熱將反應液倒入燒杯中,放入冰水浴中冷卻,析出晶體后過濾、洗滌得粗產品。
V、粗產品經提純后稱重為5.7g。
請回答下列問題:
(1)滴液漏斗的細支管a的作用是_____________,儀器b的名稱為_____________。
(2)已知用NaOH溶液吸收尾氣時發生的相關反應方程式為:
2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O;如果改用純堿溶液吸收尾氣時也能發生類似反應,則相關反應方程式為:_____________、_____________。
(3)向三口燒瓶中滴加環己醇時,要控制好環己醇的滴入速率,防止反應過于劇烈導致溫度迅速上升,否則。可能造成較嚴重的后果,試列舉一條可能產生的后果:_____________。
(4)為了除去可能的雜質和減少產品損失,可分別用冰水和_____________洗滌晶體。
(5)粗產品可用_____________法提純(填實驗操作名稱).本實驗所得到的己二酸產率為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學—選修5有機化學基礎】有機物H是一種具有很強的親水性高分子化合物。其合成路線如下:
![]()

已知:
①R—CHO+![]()
![]()

![]()
![]() ;
;
②![]()
![]()
![]() ;
;
③B的核磁共振氫譜有兩個峰,且峰面積之比為1∶2。
請回答下列問題:
(1)A的名稱是____________;B的官能團名稱是______________________;
D的結構簡式是____________________。
(2)反應⑤的反應類型是__________。
(3)反應④的化學方程式為______________________________。
(4)C的同分異構體中含有![]() 的有_________種。其中能與NaHCO3反應產生氣體的同分異構體的結構簡式是_________________________________。
的有_________種。其中能與NaHCO3反應產生氣體的同分異構體的結構簡式是_________________________________。
(5)根據已有知識并結合相關信息,仿上述流程,有機物以結構簡式來表示,寫出以甲苯和乙醛為原料制備肉桂醛( )的合成路線流程圖(無機試劑任用):
)的合成路線流程圖(無機試劑任用):
______________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應中的物質變化、能量變化、速率變化及反應的限度均是化學工作者研究的內容。
(1)對于基元反應(即反應物一步轉化為生成物的反應)mA+nB![]() pC+qQ來說,其反應速率v=k正cm(A)cn(B)(可逆反應也存在類似的表達式),k為只與溫度有關的速率常數;對于非基元反應(即不是一步完成的反應),則速率公式中的m、n就不一定均等于A、B的化學計量數,若某一物質對反應速率無影響,則其不會出現在上述公式中。
pC+qQ來說,其反應速率v=k正cm(A)cn(B)(可逆反應也存在類似的表達式),k為只與溫度有關的速率常數;對于非基元反應(即不是一步完成的反應),則速率公式中的m、n就不一定均等于A、B的化學計量數,若某一物質對反應速率無影響,則其不會出現在上述公式中。
某科研小組測量反應“H2O2+2I+2H+![]() I2+H2O”的部分實驗數據如下表所示
I2+H2O”的部分實驗數據如下表所示
c(H2O2)/(mol·L1) | c(I)/(mol·L1) | c(H+)/(mol·L1) | I2的生成速率(mol·L1·s1) |
0.010 | 0.010 | 0.010 | 1.75 |
0.030 | 0.010 | 0.10 | 5.25 |
0.030 | 0.020 | 0.10 | 1.05 |
0.030 | 0.020 | 0.20 | 1.05 |
該反應的反應速率與濃度關系表達式為_________________,速率常數k=____________,該反應_______(填“是”或“不是”)基元反應。
(2)氮的氧化物是造成大氣污染的主要成分之一,有多種方法消除氮氧化物的污染。下列 反應是消除污染的方法之一。
反應Ⅰ:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH =746 kJ·mol1
N2(g)+2CO2(g) ΔH =746 kJ·mol1
反應Ⅱ:CO(g)+NO2(g)![]() CO2(g)+ NO(g) ΔH=227 kJ·mol1
CO2(g)+ NO(g) ΔH=227 kJ·mol1
①寫出CO將NO2還原為單質的熱化學方程式 。
②已知C≡O的鍵能為1076 kJ·mol1、C=O的鍵能為745 kJ·mol1,則使1 mol NO2(g)、1 mol NO(g)分解成相應的原子所需要的能量之差是___________。
(3)向某密閉容器中通入等物質的量的CO、NO,在一定條件下發生如下反應:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH =746 kJ·mol1。測得反應在不同溫度、壓強條件下,平衡混合物中CO2的體積分數如圖1所示。又知該反應的逆反應速率公式為v逆=
N2(g)+2CO2(g) ΔH =746 kJ·mol1。測得反應在不同溫度、壓強條件下,平衡混合物中CO2的體積分數如圖1所示。又知該反應的逆反應速率公式為v逆=
k逆c2(CO2)·c(N2),實驗測得平衡時v逆與c(N2)的關系如圖2所示。
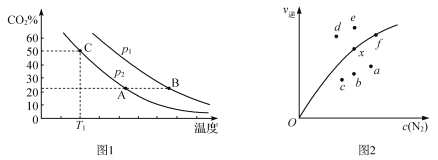
①圖Ⅰ中,A、B兩點對應的平衡常數K(A)_________K(B)(填“>”、“<”或“=”,下同),p1_______p2,C點所對應的反應中N2的產率是_______________。
②圖Ⅱ中,當x點升高到某一溫度時,反應重新達到平衡,則變為相應的點為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從廢電池外殼中回收鋅(鋅皮中常有少量鐵、外表沾有NH4Cl、ZnCl2、MnO2等雜質),制取ZnSO4·7H2O可以采取如下工藝流程:

金屬氫氧化物沉淀的pH:
氫氧化物 | 開始沉淀的pH | 完全沉淀的pH |
Zn(OH)2 | 5.7 | 8.0 |
Fe(OH)3 | 2.7 | 3.7 |
![]() 回答下列問題:
回答下列問題:
(1)酸溶時常常加入少量的CuSO4,其目的是 。
(2)寫出氧化時的離子方程式 。該過程中加入的H2O2量要遠多于理論值,原因除了提高另外反應物的轉化率外,還可能是 。
(3)調節pH大于8后會造成鋅元素轉化率降低,其原因是 。
(4)從濾液B獲得Na2SO4應該采用的方法是蒸發結晶, ,洗滌干燥。(部分物質的溶解度曲線見下圖)

(5)由濾渣B制備ZnSO4·7H2O的實驗方案為:_ __ __,干燥得到ZnSO4·7H2O (實驗中須使用的試劑有:1mol/LH2SO4,蒸餾水,乙醇;除常用儀器外須使用的儀器有:pH計)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】材料是人類生存和社會進步的物質基礎。
(1)鐵是是現代化學工業的基礎,人類進步必不可少的金屬材料。工業上冶煉鐵是在煉鐵高爐內用一氧化碳將氧化鐵還原為金屬鐵。已知:
① 2Fe(s)+ ![]() O2(g)=Fe2O3(s) △H=-824.6kJ/mol
O2(g)=Fe2O3(s) △H=-824.6kJ/mol
② CO(g)+![]() O2(g)= CO2(g) △H=-283.0kJ/mol
O2(g)= CO2(g) △H=-283.0kJ/mol
請寫出煉鐵高爐中冶鐵的熱化學方程式 。
(2)下圖表示一定溫度下,貯氫合金(M)的貯氫過程,縱軸為平衡時氫氣的壓強(p),橫軸表示固相中氫原子與金屬原子個數比(H/M)。當反應處于圖中a點時,保持溫度不變,向恒容體系中通入少量氫氣,達到平衡后反應可能處于圖中的_____點(填“b”“c”或“d”)。10g該合金2min內吸收氫氣500mL,吸氫速率v=______mLg-1min-1。

(3)氮化硅是一種耐高溫陶瓷材料。可用四氯化硅和氮氣在氫氣氣氛保護下,加強熱發生反應,可得較高純度的氮化硅,反應的化學方程式為________。
(4)高氯酸銨(NH4ClO4)是用于導彈和火箭發射推進劑的新材料。傳統制備NH4ClO4的方法是電解NaClO3水溶液得到NaClO4,再與NH4Cl進行復分解反應,經重結晶得到粗產品后,經多步精制、提純得到高純NH4ClO4。新近研究了一種制備高純NH4ClO4的新工藝,其基本方法是用惰性電極電解高純HClO得到高純HClO4,再與高純氨NH3進行噴霧反應制成高氯酸銨。
請回答下列問題:
①寫出由次氯酸電解制備高氯酸的陽極電極反應式: 。
②與傳統工藝相比,你認為新工藝有哪些優點: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是中學化學中常見有機物轉化關系(部分相關物質和反應條件已略去)
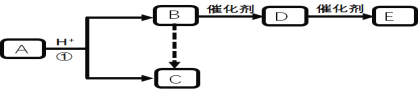
已知:Ⅰ. C的相對分子質量為60,且分子中碳元素的質量分數為40% 。
Ⅱ.B、 C、D分子含碳原子個數相同;E為高分子化合物。
回答下列問題:
(1)B中含有的官能團名稱為 。
(2)E中鏈節為 。
(3)寫出反應①的化學方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二十一世紀鈦將成為鐵、鋁之后的第三大金屬,工業上以鈦鐵礦為原料制備二氧化鈦及鈦的工藝流程如下圖所示,鈦鐵礦的主要成分為鈦酸亞鐵(FeTiO3),其中一部分鐵元素在風化過程中會轉化為+3價,FeTiO3溶于酸后Ti元素以TiO2+存在,TiOSO4遇水可水解。
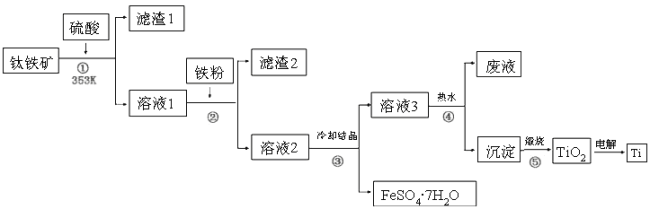
請根據以上信息回答下列問題:
(1)②中加入鐵粉的目的是__________;
(2)③中混合物分離的依據是________(填字母序號)。
a.熔、沸點差異 b.溶解性差異 c.氧化性、還原性差異
(3)②、③、④中均需要進行的操作是________(填操作名稱)。
(4)寫出④的離子方程式:_______________;該過程在熱水中操作的目的是_________
(5)利用生產過程中的廢液與軟錳礦(主要成分為MnO2)反應可生產硫酸錳(MnSO4,易溶于水),該反應的離子方程式為_______________。
(6)科學家從電解冶煉鋁的工藝得到啟發.找出了冶煉鈦的新工藝。
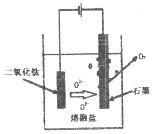
①直接電解固體TiO2法生產鈦,原理如圖所示,則陰極獲得鈦的電極反應為_____________。
②電解一段時間后,需要更換石墨電極,原因是_____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com