
【題目】一種Ru配合物與g—C3N4復合光催化劑將CO2還原為HCOOH的原理示意圖如圖。
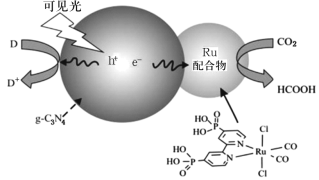
(1)Ru基態原子價電子排布式為4d75s1,寫出該元素在元素周期表中的位置___,屬于___區。
(2)HCOOH中σ鍵與π鍵的數目之比是___,HCOOH的沸點比CO2高的原因___。
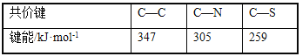
(3)紫外光的光子所具有的能量約為399kJ·mol1。根據下表有關蛋白質分子中重要化學鍵的信息,說明人體長時間照射紫外光后皮膚易受傷害的原因__。
(4)已知![]() 和
和![]() 中所有原子均共面,其中氮原子較易形成配位鍵的是___(填“前者”或“后者”)。
中所有原子均共面,其中氮原子較易形成配位鍵的是___(填“前者”或“后者”)。
(5)下列狀態的氮、氧原子中,電離最外層一個電子所需能量最大的是___(填序號,下同),最小的是___(填序號)。
A.氮![]()
B.氧![]()
C.氧![]()
D.氧![]()
(6)一種類石墨的聚合物半導體g—C3N4,其單層平面結構如圖1,晶胞結構如圖2。

①g—C3N4中氮原子的雜化類型是__;
②根據圖2,在圖1中用平行四邊形畫出一個最小重復單元___;
③已知該晶胞的體積為Vcm3,中間層原子均在晶胞內部,設阿伏加德羅常數的值為NA,則g—C3N4的密度為__g·cm-3。
【答案】第五周期Ⅷ族 d 4:1 HCOOH分子間易形成氫鍵 紫外光的光子所具有的能量比蛋白質分子中的化學鍵鍵能大,長時間照射使化學鍵斷裂,從而破壞蛋白質分子 后者 C D sp2雜化  或
或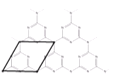
![]()
【解析】
(1)由Ru基態原子價電子排布式為4d75s1可知,Ru元素位于周期表第五周期Ⅷ族,屬于d區;
(2)碳原子形成的單鍵全是σ鍵,形成的雙鍵有一個是σ鍵、一個是π鍵,HCOOH分子中含有4個σ鍵和1個π鍵,HCOOH和CO2均為分子晶體,HCOOH分子中含有羧基,分子間能形成氫鍵,而二氧化碳分子間不能形成氫鍵;
(3)紫外光的光子所具有的能量約為399kJ/mol,比蛋白質分子中C-C、C-N和C-S的鍵能都大;
(4)![]() 中N原子參與形成大π鍵,不易給出電子對形成配位鍵,
中N原子參與形成大π鍵,不易給出電子對形成配位鍵,![]() 中N原子有一對孤電子,容易給出電子對形成配位鍵;
中N原子有一對孤電子,容易給出電子對形成配位鍵;
(5)同一元素的原子,電離最外層一個電子所需能量:激發態原子<基態的第一電離能<第二電離能;當能級處于全滿、半滿、全空時,較穩定,電離最外層一個電子需要的能量高;
(6)①該物質中N原子價層電子對數為3;
②由圖2可知,重復的結構單元為六元環和外加三個N原子形成的結構;
③由均攤法計算可得。
(1)由Ru基態原子價電子排布式為4d75s1可知,Ru元素位于周期表第五周期Ⅷ族,屬于d區,故答案為:第五周期Ⅷ族,d;
(2)碳原子形成的單鍵全是σ鍵,形成的雙鍵有一個是σ鍵,一個是π鍵,HCOOH分子中含有4個σ鍵和1個π鍵,則HCOOH分子中σ鍵與π鍵的數目之比是4:1;HCOOH和CO2均為分子晶體,HCOOH分子中含有羧基,分子間能形成氫鍵,而二氧化碳分子間不能形成氫鍵,故HCOOH的沸點比CO2高,故答案為:4:1;HCOOH分子間易形成氫鍵;
(3)紫外光的光子所具有的能量約為399kJ/mol,比蛋白質分子中C-C、C-N和C-S的鍵能都大,長時間照射紫外光能使蛋白質分子中的化學鍵斷裂,從而破壞蛋白質分子,故答案為:紫外光的光子所具有的能量比蛋白質分子中的化學鍵鍵能大,長時間照射使化學鍵斷裂,從而破壞蛋白質分子;
(4)![]() 中N原子參與形成大π鍵,不易給出電子對形成配位鍵,而
中N原子參與形成大π鍵,不易給出電子對形成配位鍵,而![]() 中N原子有一對孤電子,容易給出電子對形成配位鍵,則后者分子中氮原子較易形成配位鍵,故答案為:后者;
中N原子有一對孤電子,容易給出電子對形成配位鍵,則后者分子中氮原子較易形成配位鍵,故答案為:后者;
(5)微粒的結構越穩定,電離最外層一個電子所需能量越高,
A. ![]() 為基態N原子的軌道表示式,2p能級半充滿、較穩定;
為基態N原子的軌道表示式,2p能級半充滿、較穩定;
B. ![]() 為基態O原子的軌道表示式,失去1個電子為O的第一電離能;
為基態O原子的軌道表示式,失去1個電子為O的第一電離能;
C. ![]() 失去最外層一個電子為O的第二電離能;
失去最外層一個電子為O的第二電離能;
D. ![]() 為激發態O原子;
為激發態O原子;
同一元素的原子,電離最外層一個電子所需能量:激發態原子<基態的第一電離能<第二電離能;當能級處于全滿、半滿、全空時,較穩定,電離最外層一個電子需要的能量高,則電離最外層一個電子所需能量最大的是C,最小的是D,故答案為:C;D;
(6)①該物質中N原子價層電子對數為3,根據價層電子對互斥理論判斷N原子雜化類型為sp2雜化,故答案為:sp2雜化;
②由圖2可知,重復的結構單元為六元環和外加三個N原子形成的結構,最小重復單元如圖所示: 或
或 ,故答案為:
,故答案為: 或
或 ;
;
③由均攤法可知,該晶胞中N原子個數=8×![]() +8×
+8×![]() +2×
+2×![]() +4=8,C原子個數=3+6×
+4=8,C原子個數=3+6×![]() =6,1個晶胞的質量=
=6,1個晶胞的質量=![]() ,密度ρ=
,密度ρ=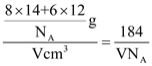 g.cm-3,故答案為:
g.cm-3,故答案為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、R為五種短周期元素,其原子半徑和最外層電子數之間的關系如圖所示,其中R元素是短周期中除稀有氣體之外原子半徑最大的元素。下列說法正確的是
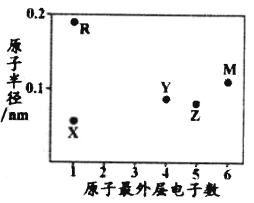
A. M元素在周期表中的位置是第2周期第ⅥA族
B. 元素的最高價氧化物對應水化物的酸性:Z<Y
C. X元素與Y、Z、M三種元素只能各形成一種共價化合物
D. Y、R的單質分別都能與其他物質反應置換出X單質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高碘酸鉀(KIO4)溶于熱水,微溶于冷水和氫氧化鉀溶液,可用作有機物的氧化劑。制備高碘酸鉀的裝置圖如下(夾持和加熱裝置省略)。回答下列問題:
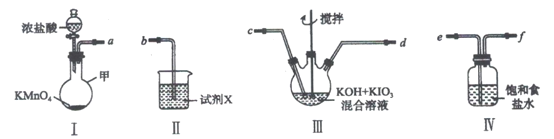
(1)裝置I中盛放濃鹽酸的儀器名稱是___________。
(2)裝置I中濃鹽酸與KMnO4混合后發生反應的離子方程式是___________。
(3)裝置Ⅱ中的試劑X的作用___________。
(4)上述炭置按氣流由左至右各接口順序為___________(用字母表示)。
(5)裝置連接好后,將裝置Ⅲ水浴加熱,通入氯氣一段時間,冷卻析岀高碘酸鉀晶體,經過濾,洗滌,干燥等步驟得到產品。
①寫出裝置Ⅲ中發生反應的化學方程式:___________。
②洗滌時,與選用熱水相比,選用冷水洗滌晶體的優點是___________。
③上述制備的產品中含少量的KIO3,其他雜質忽略,現稱取a g該產品配制成溶液,然后加入稍過量的用醋酸酸化的KI溶液,充分反應后,加入幾滴淀粉溶液,然后用1.0mol·L-1Na2S2O3標準溶液滴定至終點,消耗標準溶液的平均體積為b L。
已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O;KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O;I2+2Na2S2O3===2NaI+N2S4O6則該產品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出計算式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A、B、D、E、G、J在周期表中的位置如下:
A | |||||||
B | D | ||||||
E | G | J |
根據上表回答問題:
(1)![]() 在周期表中的位置是______,D的原子結構示意圖_____。
在周期表中的位置是______,D的原子結構示意圖_____。
(2)![]() 、B、E、G的原子半徑由大到小的順序是_____
、B、E、G的原子半徑由大到小的順序是_____![]() 填元素符號
填元素符號![]() 。
。
(3)![]() 、D的氣態氫化物的穩定性關系為______
、D的氣態氫化物的穩定性關系為______![]() 填化學式
填化學式![]() ,它們都屬于______
,它們都屬于______![]() 離子化合物或共價化合物
離子化合物或共價化合物![]() 。
。
(4)第三周期元素的最高價氧化物對應的水化物中,有一種物質既能與強酸反應又能與強堿反應,寫出這種物質跟氫氧化鈉溶液反應的化學方程式________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】298K時,向20mL均為0.1mol·L-1的MOH和NH3·H2O混合液中滴加0.1mol·L-1的CH3COOH溶液,測得混合液的電阻率(表示電阻特性的物理量)與加入CH3COOH溶液的體積(V)的關系如圖所示。已知:CH3COOH的Ka=l.8×10-5,NH3H2O的Kb=l.8×l0-5。下列說法錯誤的是( )
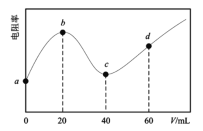
A.堿性:MOH>NH3·H2O
B.c點溶液中濃度:c(CH3COOH)>c(NH3H2O)
C.d點溶液的pH≈5
D.a→d過程中水的電離程度先減小后增大
查看答案和解析>>
科目:高中化學 來源: 題型:
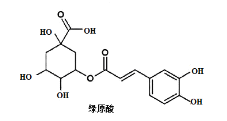
【題目】傳統中藥“金銀花”中抗菌殺毒的有效成分是“綠原酸”。某高中化學創新興趣小組運用所學知識并參考相關文獻,設計了一種“綠原酸”的合成路線如圖:
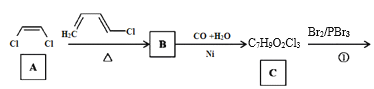
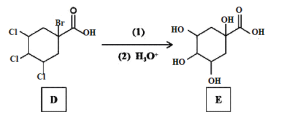
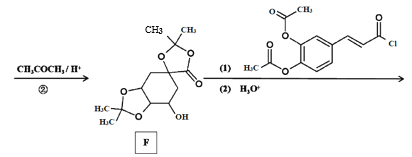
已知:① ;
;
②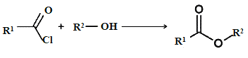 。
。
回答下列問題:
(1)有機物A的名稱是___,A→B的反應類型___。
(2)C的結構簡式___,有機物F中官能團的名稱是___。
(3)若碳原子上連有4個不同的原子或基團時,該碳原子稱為手性碳。用星號(*)標出E中的手性碳: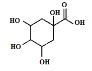 ___。
___。
(4)反應②的目的是__,寫出D→E中第(1)步的反應方程式___。
(5)綠原酸在堿性條件下完全水解后,再酸化,得到的芳香族化合物的同分異構體有多種,滿足以下條件的有___種(不考慮立體異構,任寫一種)。
a.含有苯環
b.1mol該物質能與2molNaHCO3反應
寫出核磁共振氫譜顯示峰面積之比為3:2:2:1的結構簡式為__。
(6)參照上述合成方法,設計由丙酸為原料制備高吸水性樹脂聚丙烯酸鈉的合成路線___(無機試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活、環境密切相關,下列有關說法正確的是( )
A.污水中![]() ,
,![]() ,
,![]() 等有毒,可用
等有毒,可用![]() 處理
處理
B.采取“靜電除塵”“燃煤固硫”“汽車尾氣催化凈化”等方法,可提高空氣質量
C.谷氨酸一鈉用于調味,小蘇打不可用于油污清洗
D.我國全面啟動的北斗導航系統的信號傳輸與硅有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的變化曲線如圖所示。下列說法錯誤的是

A. a點所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA)
B. a、b兩點所示溶液中水的電離程度a點大于b點
C. pH=7時,c(Na+)=c(A-)+c(HA)
D. 一元酸HA為弱酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯酸鎂[Mg(ClO3)2]常用作催熟劑、除草劑等,實驗室制備少量Mg(ClO3)2·6H2O的流程如圖:
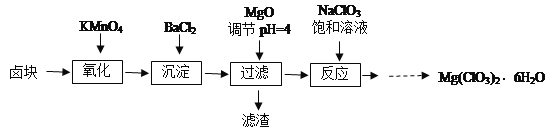
已知:①鹵塊主要成分為MgCl2·6H2O,含有MgSO4、FeCl2等雜質。
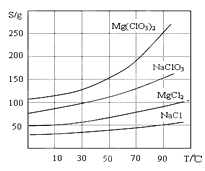
②四種化合物的溶解度(S)隨溫度(T )變化曲線如圖所示:
(1)過濾所需要的玻璃儀器有______。
(2)如圖是某學生的過濾操作示意圖,其操作不規范的是______(填標號)。
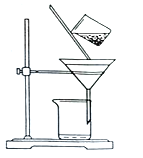
a.漏斗末端頸尖未緊靠燒杯壁
b.玻璃棒用作引流
c.將濾紙濕潤,使其緊貼漏斗壁
d.濾紙邊緣高出漏斗
e.用玻璃棒在漏斗中輕輕攪動以加快過濾速度
(3)加入BaCl2的目的是除去SO42-,如何檢驗SO42-已沉淀全?______
(4)加入NaClO3飽和溶液會發生如下反應:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,請利用該反應,結合圖像,制取Mg(ClO3)2·6H2O的實驗步驟依次為:①取樣,加入NaClO3飽和溶液充分反應,②______;③______;④______;⑤過濾、洗滌,獲得Mg(ClO3)2·6H2O晶體。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com