
【題目】某同學根據課本第50頁科學探究實驗,用三支試管、水槽、膠塞、導管、酒精噴燈及其它必要的儀器和物品,設計了以下實驗裝置,完成高溫下“Fe與水蒸氣的反應實驗”。請回答該實驗中的問題。
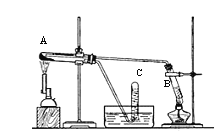
(1)寫出該反應的化學方程式________。
(2)試管A中裝的試劑是________ ;試管B中裝的試劑是________。
(3)試管C中收集氣體的方法叫作_________;收集的氣體是(填化學式)_____。
(4)如果要在氣體導出管口點燃該氣體,則必須對該氣體進行 _______。
(5)該同學欲確定反應后A試管中還原鐵粉是否完全反應。設計了如下實驗方案:第I步:待A試管冷卻后,取少許其中的固體物質溶于稀硫酸,得溶液x;第II步:取少量溶液x滴加KSCN溶液,若溶液變紅色則說明溶液x中含有_________。
①甲同學按照上述實驗方案進行了實驗,結果溶液未變紅色,原因是(用離子方程式表示)____。
②乙同學按照上述實驗方案進行了實驗,結果溶液變紅色。得出結論:A試管中還原鐵粉反應完全。你覺得該結論是否合理?_______(填“合理”或“不合理”)請說明理由___________。(如果認為合理,此空不答。)
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2 鐵粉或Fe 蒸餾水或H2O 排水法 H2 驗純 Fe3+ 2Fe3++Fe=3Fe2+ 不合理 如果剩余少量的鐵粉,則溶液中Fe3+與Fe反應之后還有剩余
Fe3O4+4H2 鐵粉或Fe 蒸餾水或H2O 排水法 H2 驗純 Fe3+ 2Fe3++Fe=3Fe2+ 不合理 如果剩余少量的鐵粉,則溶液中Fe3+與Fe反應之后還有剩余
【解析】
(1)鐵與水蒸氣在高溫條件下反應;
(2)A中為固體,B中為液體;
(3)反應生成了氫氣;
(4)易燃氣體不純,點燃易爆炸;
(5)三價鐵離子遇硫氰化鉀溶液溶液變為紅色;
①若溶液未變紅色,說明溶液中沒有三價鐵離子;
②鐵粉與三價鐵離子能夠反應生成二價鐵離子。
:(1)鐵與水蒸氣反應高溫條件下生成四氧化三鐵和氫氣,反應方程式為:3Fe+4H2O(g)![]() Fe3O4+4H2,故答案為:3Fe+4H2O(g)
Fe3O4+4H2,故答案為:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)A中為鐵粉,B中為蒸餾水,加熱變為蒸汽,通入到A中,故答案為:鐵粉;H2O;
(3)C裝置為排水集氣法,反應生成了氫氣,氫氣難溶于水,可以用排水法收集,故答案為:排水法;H2;
(4)氫氣為易燃氣體,氫氣不純時點燃容易爆炸,在點燃之前要注意驗純,故答案為:驗純;
(5)加入硫氰化鉀溶液,溶液變為紅色,說明溶液中有三價鐵離子,故答案為:Fe3+;
①溶液沒有變紅,說明溶液中的三價鐵被反應消耗掉了,反應方程式為:2Fe3++Fe=3Fe2+,故答案為:2Fe3++Fe=3Fe2+;
②乙同學的結論不合理,鐵粉也可以沒有完全反應,剩余的少量的鐵粉與三價鐵離子反應后三價鐵離子還有剩余,所以溶液還會變紅,
故答案為:不合理;如果剩余少量的鐵粉,則溶液中Fe3+與Fe反應之后還有剩余。


 鷹派教輔銜接教材河北教育出版社系列答案
鷹派教輔銜接教材河北教育出版社系列答案 初中暑期銜接系列答案
初中暑期銜接系列答案科目:高中化學 來源: 題型:
【題目】下列所列各組物質中,物質之間通過一步反應就能實現如圖所示轉化的是
a | b | c | |
A | Al2O3 | AlCl3 | Al(OH)3 |
B | NH3 | NO | NO2 |
C | Si | SiO2 | H2SiO3 |
D | Fe | FeCl2 | FeCl3 |
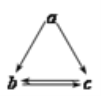
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.C6H14的同分異構體共有5種
B.H2O、H2O2互為同素異形體
C.H2、CH4、C2H6互為同系物
D.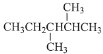 的名稱為:3,4—二甲基戊烷
的名稱為:3,4—二甲基戊烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示:若關閉Ⅰ閥,打開Ⅱ閥,讓潮濕的氯氣經過甲瓶后,通入乙瓶,布條不褪色;若關閉Ⅱ閥打開Ⅰ閥,再通入這種氣體,布條褪色。甲瓶中所盛的試劑不可能是

A. 濃H2SO4B. NaOH溶液C. NaCl溶液D. Ca(OH)2溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
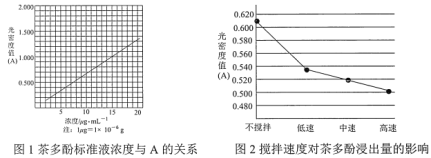
【題目】茶葉中的茶多酚是一種天然抗氧化劑(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,難溶于氯仿。在酸性介質中,茶多酚能將Fe3+還原為Fe2+,Fe2+與![]() 生成的深藍色配位化合物
生成的深藍色配位化合物![]() 對特定波長光的吸收程度(用光密度值A表示)與茶多酚在一定濃度范圍內成正比。A與茶多酚標準液濃度的關系如圖1所示:
對特定波長光的吸收程度(用光密度值A表示)與茶多酚在一定濃度范圍內成正比。A與茶多酚標準液濃度的關系如圖1所示:
某實驗小組設計如下實驗流程從茶葉中提取茶多酚:
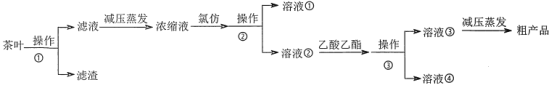
請回答下列問題:
(1)操作①用水浸取茶多酚時,實驗小組發現攪拌速度對茶多酚浸出量的影響如圖2所示,原因是____。若用乙醇浸取茶多酚操作如下:稱取10g茶葉末,用濾紙包好,裝入恒壓滴液漏斗中,圓底燒瓶內加沸石和適量乙醇,如圖3安裝后,通冷凝水,加熱套加熱,當乙醇被加熱沸騰后,控制加熱套溫度在90℃。為使恒壓漏斗內液面高出茶葉包約0.5cm,并保持約1h,可行的操作方法是____。
(2)減壓蒸發相對于一般蒸發的優點是____。氯仿的作用是____。
(3)下列有關實驗基本操作不正確的是___。
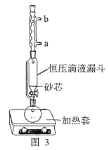
A. 圖3中冷凝水流向為a進b出
B. 分液漏斗使用前須檢驗是否漏水并洗凈備用
C. 操作①過濾時,可用玻璃棒適當攪拌以加快分離速度
D. 萃取過程中,經振搖并放氣后,將分液漏斗置于鐵圈上立即分液
(4)下列關于振搖操作的示意圖,正確的是____。
A. 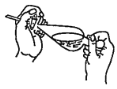 B.
B. 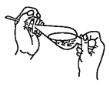 C.
C.  D.
D. 
(5)稱取1.25g粗產品,用蒸餾水溶解并定容至1000mL,移取該溶液1.00mL,加過量Fe3+和![]() 酸性溶液,用蒸餾水定容至100mL后,測得溶液光密度值A=0.800,則產品的純度是____(以質量分數表示)。
酸性溶液,用蒸餾水定容至100mL后,測得溶液光密度值A=0.800,則產品的純度是____(以質量分數表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】青蒿素是只含碳、氫、氧三元素的有機物,是高效的抗瘧藥,為無色針狀晶體,易溶于乙醚中,在水中幾乎不溶,熔點為156~157℃,已知乙醚沸點為35℃,從青蒿中提取青蒿素的方法之一是以萃取原理為基礎,以乙醚浸取法的主要工藝如圖所示:
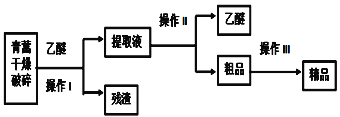
回答下列問題:
(1)選用乙醚浸取青蒿素的原因是______。
(2)操作I需要的玻璃儀器主要有:燒杯、玻璃棒和________ ,操作Ⅱ的名稱是__________,操作Ⅲ利用青蒿素和雜質在同一溶劑中的溶解性差異及青蒿素溶解度隨溫度變化較大的原理提純,這種方法是______________。
(3)通常用燃燒的方法測定有機物的分子式,可在燃燒室內將有機物樣品與純氧在電爐加熱下充分燃燒,根據產品的質量確定有機物的組成,如圖所示的是用燃燒法確定青蒿素分子式的裝置:
A.  B.
B. 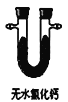 C.
C. 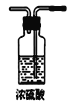 D.
D.  E.
E. 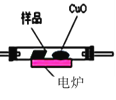
①按上述所給的測量信息,裝置的連接順序應是_____________。(裝置可重復使用)
②青蒿素樣品的質量為28.2g,用連接好的裝置進行試驗,稱得A管增重66g,B管增重19.8g,則測得青蒿素的最簡式是_____________。
③要確定該有機物的分子式,還必須知道的數據是_________,可用__________儀進行測定。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗合理的是
A.用![]() 懸濁液不能鑒別乙醇、乙醛、乙酸
懸濁液不能鑒別乙醇、乙醛、乙酸
B.焰色反應后,要用稀硫酸洗滌鉑絲并在火焰上燃燒至無色
C.可用O2除去CO2中混有的CO
D.將溴水中的溴提取出來的方法是用CCl4少量多次進行萃取
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關系正確的是( )
A.密度:CCl4>H2O>苯
B.同質量的物質燃燒耗 O2 量:丙炔>乙炔>甲烷
C.熔點:戊烷>2,2 -二甲基戊烷>2,3 -二甲基丁烷>丙烷
D.同物質的量物質燃燒耗 O2 量:己烷>環己烷>苯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組制備氯氣并對產生氯氣的條件進行探究。
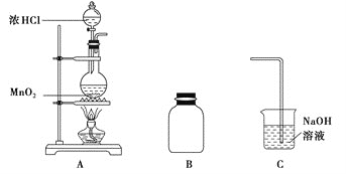
(1)裝置A中用MnO2與濃鹽酸反應制取Cl2,利用了濃HCl的___________(填“氧化性”或“還原性”)。
(2)A中產生的氣體不純,含有的雜質可能是___________。
(3)B用于收集Cl2,請完善裝置B并用箭頭標明進出氣體方向_____________。
(4)C用于吸收多余的Cl2,C中發生反應的離子方程式是____________________________________________________________。
(5)該小組欲研究鹽酸的濃度對制Cl2的影響,設計實驗進行如下探究。
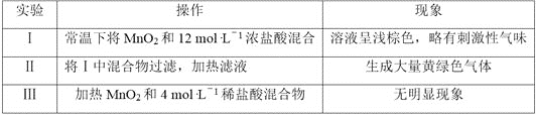
①已知MnO2呈弱堿性。 Ⅰ中溶液呈淺棕色是由于MnO2與濃鹽酸發生了復分解反應,化學方程式是___________________________________________________。
②Ⅱ中發生了分解反應,反應的化學方程式是__________________________________。
③Ⅲ中無明顯現象的原因,可能是c(H+)或c(Cl-)較低,設計實驗Ⅳ進行探究:

將實驗Ⅲ、Ⅳ作對比,得出的結論是____________________________;
將ⅰ、ⅱ作對比,得出的結論是___________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com