
【題目】下圖表示有關的一種反應物或生成物(無關物質已略去),其中A、C為無色氣體,請填寫下列空白。

(1)B是____________,W是__________。(填化學式)
(2)用單線橋法標出反應①電子轉移的方向和數目:_________________。
(3)寫出G與Cu在加熱條件下能反應生成E和F的物質的量之比為1∶1的化學方程式:________________________________________________________________________。
(4)若W是酸式鹽,_________g W加熱分解的產物通過足量的Na2O2,固體Na2O2增重3g,則轉移的電子總數為__________。
【答案】H2O NH4HCO3或(NH4)2CO3(答對任意一個給滿分)![]() 2Cu+6HNO3
2Cu+6HNO3![]() 2Cu(NO3)2+NO↑+NO2↑+3H2O7.9g0.2NA
2Cu(NO3)2+NO↑+NO2↑+3H2O7.9g0.2NA
【解析】
W既能與鹽酸反應,又能與NaOH反應,都生成氣體,應為弱酸銨鹽,則A為NH3,氣體C能與Na2O2反應,應是二氧化碳與過氧化鈉反應,故C為CO2,則W應為碳酸銨或碳酸氫銨,B為H2O,結合轉化關系可知,D為O2,E為NO,F為NO2,G為HNO3,(1)由上分析B為H2O;W應為(NH4)2CO3或者NH4HCO3;反應①是CO2與Na2O2反應生成Na2CO3和O2,用單線橋法標出反應電子轉移的方向和數目為:![]() ;(3) G為HNO3,與Cu在加熱條件下能反應生成NO和NO2的物質的量之比為1∶1的化學反應,根據氧化還原反應配平可得反應方程式為:2Cu+6HNO3
;(3) G為HNO3,與Cu在加熱條件下能反應生成NO和NO2的物質的量之比為1∶1的化學反應,根據氧化還原反應配平可得反應方程式為:2Cu+6HNO3![]() 2Cu(NO3)2+NO↑+NO2↑+3H2O;(4) 若W是酸式鹽則為NH4HCO3,NH4HCO3加熱分解的產物為氨氣、二氧化碳和水蒸氣NH4HCO3
2Cu(NO3)2+NO↑+NO2↑+3H2O;(4) 若W是酸式鹽則為NH4HCO3,NH4HCO3加熱分解的產物為氨氣、二氧化碳和水蒸氣NH4HCO3![]() NH3↑+ CO2+H2O,該反應的產物通過足量的Na2O2,能與過氧化鈉反應且使其增重的為二氧化碳和水,根據反應2CO2+2Na2O2= 2Na2CO3+O2、2H2O+2Na2O2= 4NaOH+O2↑,固體Na2O2增重3g,由于每摩二氧化碳可增重28g、每摩水可增重2g,則n(CO2+H2O)=
NH3↑+ CO2+H2O,該反應的產物通過足量的Na2O2,能與過氧化鈉反應且使其增重的為二氧化碳和水,根據反應2CO2+2Na2O2= 2Na2CO3+O2、2H2O+2Na2O2= 4NaOH+O2↑,固體Na2O2增重3g,由于每摩二氧化碳可增重28g、每摩水可增重2g,則n(CO2+H2O)=![]() ,則分解NH4HCO3的為
,則分解NH4HCO3的為![]() ,質量為
,質量為![]() ;轉移的電子總數為
;轉移的電子總數為![]() 。
。


 期末1卷素質教育評估卷系列答案
期末1卷素質教育評估卷系列答案科目:高中化學 來源: 題型:
【題目】我國古代四大發明之一的黑火藥是由硫磺粉、硝酸鉀和木炭粉按一定比例混合而成的,爆炸的反應為:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列說法中正確的是 ( )
K2S+N2↑+3CO2↑,下列說法中正確的是 ( )
A. 該反應中的還原劑為KNO3
B. 該反應中C被還原
C. 若消耗32g S,該反應轉移電子數為2 NA
D. 若生成標準狀況下氣體22.4L,則有0.75 mol物質被還原
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據海水綜合利用的工業流程圖,判斷下列說法不正確的是( )

A. 除去粗鹽中雜質(Mg2+、SO42-、Ca2+),加入的藥品順序為:NaOH溶液→BaCl2溶液→Na2CO3溶液→過濾后加鹽酸
B. 在過程②中將MgCl2·6H2O灼燒即可制得無水MgCl2
C. 從能量轉換角度看,氯堿工業電解飽和食鹽水是一個將電能轉化為化學能的過程
D. 從第④步到第⑤步的目的是富集Br2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某無色溶液中,可能含有Mg2+、Al3+、Fe2+、NH4+、H+、AlO2-、Cl-中的一種或幾種離子,向其中緩慢地滴入NaOH溶液直至過量,產生沉淀的物質的量與加入的NaOH溶液體積的關系如圖所示,由此確定,無色溶液中含有的離子是( )

A. Mg2+、Al3+、Fe2+、Cl-
B. H+、Mg2+、Al3+、NH4+
C. H+、Mg2+、Al3+、NH4+、Cl-
D. Mg2+、NH4+、AlO2-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯酸鎂常用作催熟劑、除草劑等,實驗室制備Mg(C1O3)2·6H2O 的流程如下:
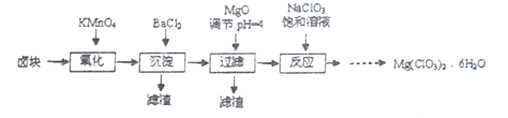
已知:①鹵塊主要成分為MgCl2·6H2O,含有MgSO4、FeCl2等雜質。
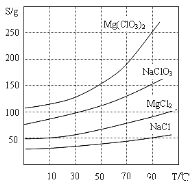
②四種化合物的溶解度(S)隨溫度(T)變化曲線如圖所示。
(1)過濾所需要的主要玻璃儀器有_________。
(2)加MgO后過濾所得濾渣的主要成分的化學式為_________。
(3)加入NaClO3飽和溶液后發生反應的化學方程式為__________,再進一步制取Mg(ClO3)2·6H2O的實驗步驟依次為:①________;______;洗滌;②將濾液冷卻結晶;③過濾、洗滌。
(4)產品中Mg(ClO3)2·6H2O含量的測定:(已知Mg(ClO3)2·6H2O的摩爾質量為299 g/mol)
步驟1:準確稱量3.50g產品配成100 mL溶液。
步驟2:取10.00mL于錐形瓶中,加入10.00mL稀硫酸和20.00mL1.000mol·L-1的FeSO4溶液,微熱。
步驟3:冷卻至室溫,用0.100mol/LK2Cr2O7 溶液滴定剩余的Fe2+至終點。反應的方程式為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步驟4:將步驟2、3重復兩次,平均消耗K2Cr2O7 溶液15.00mL。
① 寫出步驟2中發生反應的離子方程式__________;
② 產品中Mg(ClO3)2·6H2O的質量分數為_______。(保留到小數點后一位)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黃銅礦不僅可用于火法煉銅,也可用于濕法煉銅,濕法可同時生產銅、磁性氧化鐵和用于橡膠工業的一種固體物質A,流程如下:
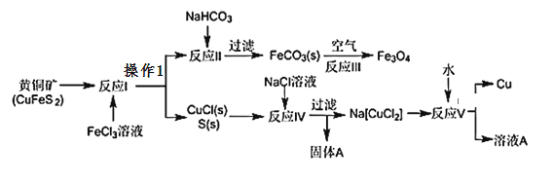
(1)黃銅礦中Cu的化合價是______,反應I中________molFeC13 可氧化0.1mol CuFeS2。
(2)實驗室在進行操作1時,除使用燒杯外,還需使用的玻璃儀器有___________。
(3)工業生產中的過濾操作多采用傾析法(傾析法:先把清液傾入漏斗中,讓沉淀盡可能地留在燒杯內)分離出固體物質,下列適合用傾析法的有____________。
a.沉淀的顆粒較大 b.沉淀呈膠狀 c.沉淀容易沉降 d.沉淀呈絮狀。
(4)固體物質A的成分________(寫名稱),本流程中可實現循環使用的物質除水外還有_______________
(5)反應Ⅲ是在設備底部鼓入空氣,高溫氧化鍛燒法來制備磁性氧化鐵,寫出對應的化學方程式_________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活、環境、材料信息關系密切,下列說法不正確的是
A. 鍋爐水垢中含有的CaSO4,可先用Na2CO3溶液處理,后用酸除去
B. 有一種新發現的固態碳,這種碳的結構稱為“納米泡沫”,外形類似海綿,密度小且有磁性。這種碳與金剛石的關系是互為同素異形體
C. 聚乙炔用I2或Na 等摻雜處理后可形成一種導電塑料,該導電塑料有固定的熔、沸點
D. 工業上電解熔融的氯化鈉、氯化鎂、氧化鋁來制取鈉、鎂、鋁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將0.05 mol Na2CO3固體溶于水配成100mL溶液,向溶液中加入下列物質。有關結論正確的是
加入的物質 | 結論 | |
A | 50mL 1 mol/LH2SO4 | 反應結束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中c(OH-) /c(HCO3-) 增大 |
C | 50mL H2O | 由水電離出的c(H+)·c(OH—)不變 |
D | 0.1molNaHSO4固體 | 反應完全后,溶液pH減小,c(Na+)不變 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】24mL濃度為0.05mol/L的Na2SO3溶液,恰好與20mL濃度為0.02mol/L的 K2Cr2O7 溶液完全反應,則元素Cr在還原產物中的化合價是( )
A.+6
B.+3
C.+2
D.0
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com