
【題目】研究物質的合成或制備是有機化學、無機化學的重要任務之一.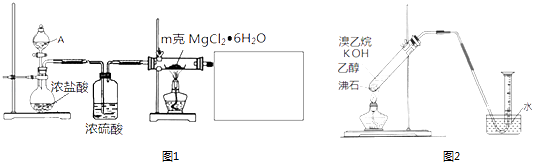
(1)某實驗小組探究實驗室制備無水氯化鎂的方法,設計了圖1裝置①分液漏斗中的A物質是(填試劑名稱).
②利用中學常見的儀器,空白方框內補充完整實驗裝置 .
可選擇的試劑有:A.稀NaOH溶液 B.無水氯化鈣 C.稀硫酸 D.濃硫酸
③假設實驗過程中 MgCl26H2O 未水解,不用任何試劑用最簡單的方法檢驗MgCl26H2O 是否完全轉化為MgCl2 . 寫出實驗方法 .
(2)實驗室制備并收集純凈乙烯①有的同學通過乙醇制備乙烯,寫出相關化學方程式: .
該實驗除乙醇外,所需的試劑或用品(不包括儀器)有、、 .
②有的同學探究其它制備乙烯的方法,他設計了圖2裝置制備乙烯.實驗結果是量筒內壁附著較多無色油狀液體,且得到很少量的氣體.
請分析氣體產率很低的原因主要是 .
為增大氣體產率,在右圖裝置的基礎上,提出一點改進措施: .
【答案】
(1)濃硫酸;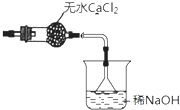 ;稱量所得產物質量,若質量為
;稱量所得產物質量,若質量為 ![]() g,說明MgCl2?6H2O完全轉化為MgCl2 , 否則未完全
g,說明MgCl2?6H2O完全轉化為MgCl2 , 否則未完全
(2)CH3CH2OH ![]() CH2=CH2↑+H2O;濃硫酸;氫氧化鈉溶液;沸石;加熱溫度過高,溴乙烷大量揮發,也可能是溴乙烷發生副反應等;增加冷凝回流裝置等
CH2=CH2↑+H2O;濃硫酸;氫氧化鈉溶液;沸石;加熱溫度過高,溴乙烷大量揮發,也可能是溴乙烷發生副反應等;增加冷凝回流裝置等
【解析】解:(1)加熱氯化鎂晶體失去結晶水得到無水氯化鎂,由于氯化鎂易水解,應在HCl氛圍中加熱分解,A中液體為濃硫酸,與圓底燒瓶中濃鹽酸混合,發生大量的熱,利用HCl逸出,洗氣瓶中濃硫酸干燥HCl,利用氫氧化鈉溶液吸收尾氣中HCl,防止污染空氣,注意防止倒吸,還要防止氫氧化鈉溶液中水蒸氣導致氯化鎂水解,尾氣處理裝置與加熱裝置之間需要連接盛放氯化鈣的干燥管(或盛放濃硫酸的洗氣瓶);①由上述分析可知,分液漏斗中的A物質是濃硫酸,所以答案是:濃硫酸;②利用氫氧化鈉溶液吸收尾氣中HCl,防止污染空氣,且防止倒吸,還要在尾氣處理裝置與加熱裝置之間需要連接盛放氯化鈣的干燥管(或盛放濃硫酸的洗氣瓶),防止氯化鎂水解,需要補充完整實驗裝置為:  等, 所以答案是:
等, 所以答案是:  等;③實驗過程中MgCl26H2O未水解,mg晶體的物質的量為
等;③實驗過程中MgCl26H2O未水解,mg晶體的物質的量為 ![]() mol,完全分解得到氯化鎂為
mol,完全分解得到氯化鎂為 ![]() mol×95g/mol=
mol×95g/mol= ![]() g,稱量所得產物質量,若質量為
g,稱量所得產物質量,若質量為 ![]() g,說明MgCl26H2O完全轉化為MgCl2 , 否則未完全,所以答案是:稱量所得產物質量,若質量為
g,說明MgCl26H2O完全轉化為MgCl2 , 否則未完全,所以答案是:稱量所得產物質量,若質量為 ![]() g,說明MgCl26H2O完全轉化為MgCl2 , 否則未完全;(2)①乙醇在濃硫酸作用下發生消去反應生成乙烯,反應方程式為:CH3CH2OH
g,說明MgCl26H2O完全轉化為MgCl2 , 否則未完全;(2)①乙醇在濃硫酸作用下發生消去反應生成乙烯,反應方程式為:CH3CH2OH ![]() CH2=CH2↑+H2O,反應中會發生副反應,有二氧化碳、二氧化硫生成,用氫氧化鈉溶液吸收除去二氧化碳、二氧化硫,液體加熱需要防止暴沸,還需要加入沸石,除乙醇外,所需的試劑或用品(不包括儀器)有:濃硫酸、氫氧化鈉溶液、沸石,所以答案是:CH3CH2OH
CH2=CH2↑+H2O,反應中會發生副反應,有二氧化碳、二氧化硫生成,用氫氧化鈉溶液吸收除去二氧化碳、二氧化硫,液體加熱需要防止暴沸,還需要加入沸石,除乙醇外,所需的試劑或用品(不包括儀器)有:濃硫酸、氫氧化鈉溶液、沸石,所以答案是:CH3CH2OH ![]() CH2=CH2↑+H2O;濃硫酸、氫氧化鈉溶液、沸石;②方案中利用溴乙烷發生消去反應生成乙烯,利用圖中裝置制備乙烯,實驗結果是量筒內壁附著較多無色油狀液體,且得到很少量的氣體,說明生成乙烯很少,大量的溴乙烷揮發,氣體產率很低的原因主要是:加熱溫度過高,溴乙烷大量揮發,也可能是溴乙烷發生副反應等;為增大氣體產率,可以增加冷凝回流裝置,有利于溴乙烷冷凝回流,可以利用水浴加熱,便于控制溫度等,減少溴乙烷揮發,所以答案是:加熱溫度過高,溴乙烷大量揮發,也可能是溴乙烷發生副反應等;增加冷凝回流裝置等.
CH2=CH2↑+H2O;濃硫酸、氫氧化鈉溶液、沸石;②方案中利用溴乙烷發生消去反應生成乙烯,利用圖中裝置制備乙烯,實驗結果是量筒內壁附著較多無色油狀液體,且得到很少量的氣體,說明生成乙烯很少,大量的溴乙烷揮發,氣體產率很低的原因主要是:加熱溫度過高,溴乙烷大量揮發,也可能是溴乙烷發生副反應等;為增大氣體產率,可以增加冷凝回流裝置,有利于溴乙烷冷凝回流,可以利用水浴加熱,便于控制溫度等,減少溴乙烷揮發,所以答案是:加熱溫度過高,溴乙烷大量揮發,也可能是溴乙烷發生副反應等;增加冷凝回流裝置等.


科目:高中化學 來源: 題型:
【題目】現有三組溶液:①汽油和水溶液 ②39%的乙醇溶液 ③氯化鈉和單質溴的水溶液。分離以上各混合液的正確方法依次是( )
A. 分液、蒸餾、萃取B. 萃取、蒸發、分液
C. 分液、萃取、蒸餾D. 蒸餾、萃取、分液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D為原子序數依次增大的四種元素,A2﹣和B+具有相同的電子構型;C、D為同周期元索,C核外電子總數是最外層電子數的3倍;D元素最外層有一個未成對電子.回答下列問題:
(1)四種元素中電負性最大的是(填元素符號),其中C原子的核外電子排布式為 .
(2)單質A有兩種同素異形體,其中沸點高的是(填分子式),原因是;A和B的氫化物所屬的晶體類型分別為和 .
(3)C和D反應可生成組成比為1:3的化合物E,E的立體構型為 , 中心原子的雜化軌道類型 .
(4)化合物D2A的立體構型為 , 中心原子的價層電子對數為 , 單質D與濕潤的Na2CO3反應可制備D2A,其化學方程式為 .
(5)A和B能夠形成化合物F,其晶胞結構如圖所示,晶胞參數a=0.566nm,F的化學式為 , 晶胞中A原子的配位數為;列式計算晶體F的密度(gcm﹣3).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】8g NaOH固體溶于水配成1000 mL溶液,取出其中的10 mL,該10 mL NaOH溶液的物質的量濃度為 ( )
A. 1 molL-1 B. 0.5 molL-1 C. 0.25 molL-1 D. 0.2 molL-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我們可以用水解度來表示鹽水解程度的大小,它是用已水解的物質的量占原來總的電解質物質的量的分數來表示的.若測得2L 0.1mol/L的強堿弱酸鹽NaA溶液的常溫下的pH為10,則A﹣的水解度為( )
A.0.01%
B.0.1%
C.0.2%
D.1%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同溫同壓下,2體積氣體A2和1體積氣體B2完全反應生成了2體積氣體X,則X的化學式是( )
A. A2BB. A2B2C. AB2D. AB3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究表明,化學反應的能量變化(△H)與反應物和生成物的鍵能有關.鍵能可以簡單的理解為斷開1mol化學鍵時所需吸收的能量.下表是部分化學鍵的鍵能數據:
化學鍵 | P﹣P | P﹣O | O=O | P=O |
鍵能/kJmol﹣1 | 197 | 360 | 499 | X |
已知白磷的燃燒熱為2378.0kJ/mol,白磷完全燃燒的產物結構如圖所示,則上表中X=kJmol﹣1 . ( )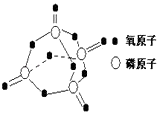
A.1057.5 kJmol﹣1
B.335.25 kJmol﹣1
C.433.75 kJmol﹣1
D.959.0 kJmol﹣1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com