
【題目】下列說法中正確的是
A.純凈物中一定存在化學鍵
B.陰、陽離子間通過靜電引力而形成的化學鍵叫做離子鍵
C.只有金屬元素和非金屬元素化合時才能形成離子鍵
D.離子化合物中可能含共價鍵,共價化合物中不含離子鍵
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A.麥芽糖及其水解產物均能發生銀鏡反應
B.在酸性條件下,CH3CO18OC2H5的水解產物是CH3CO18OH和C2H5OH
C.用溴水即可鑒別苯酚溶液、2,4﹣已二烯和甲苯
D.用甘氨酸(H2N﹣CH2﹣COOH)和丙氨酸( ![]() )縮合最多可形成4種二肽
)縮合最多可形成4種二肽
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若將反應:Zn+H2SO4=ZnSO4+H2↑設計成原電池(裝置如圖),則下列說法正確的是( ) 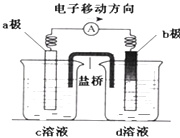
A.d溶液是稀硫酸
B.c溶液顏色變藍
C.b極發生氧化反應
D.a極是銅棒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素X、Y、R、M的原子序數依次增大,其中只有R屬于金屬元素,由X、Y、R可組成一種化合物Q,在298K時,0.1mol·L—1 Q溶液的AG(酸度)=lg![]() =-12,由X和M組成的化合物XM是強電解質。下列說法正確的是
=-12,由X和M組成的化合物XM是強電解質。下列說法正確的是
A. Y、R、M三種元素形成的簡單離子半徑:r(M)>r(R)>r(Y)
B. M的氧化物對應的水化物一定是強酸
C. R分別與X、Y、M組成的二元化合物中都含有離子鍵
D. 化合物RYX和RMY均能抑制水的電離
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,用甲醇和氧氣以及強堿做電解質溶液的新型燃料電池做電源,對A、B 裝置通電一段時間后,發現有3.2g甲醇參加反應且③電極增重(假設工作時無能量損失).請回答下列問題: 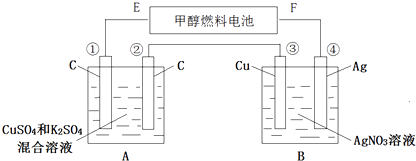
(1)F電極的名稱是 , E電極的反應式: .
(2)④電極的反應式: , 通電一段時間后B池pH(填“變大”“變小”“不變”).
(3)若A池中原混合液的體積為500mL,CuSO4、K2SO4濃度均為0.3mol/L,電解過程中A池中共收集到標準狀況下的氣體L,①、③電極析出固體物質的量之比 .
(4)欲使通電后的溶液恢復至原狀,可加入一種物質是(寫名稱).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到氣體V L(標準狀況),向反應后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,產生藍色沉淀,過濾,洗滌,灼燒,得到CuO 12.0g,若上述氣體為NO和NO2的混合物,且體積比為1:1,則V可能為( )
A.7.5 L
B.12.3 L
C.15.7 L
D.16.8 L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇(CH3OH)是重要的溶劑和替代燃料。CO和H2的混合氣體俗稱合成氣,可以在一定條件下制備CH3OH。
(1)若在密閉容器中充入CO和H2,研究其它條件不變時溫度對合成甲醇反應影響:CO(g)+2H2(g) ![]() CH3OH(g),實驗結果如圖所示。
CH3OH(g),實驗結果如圖所示。

①溫度高低比較:T1____T2。
②下列判斷正確的是______________。
A.該反應是放熱反應
B.該反應在T1時的平衡常數比T2時的小
C.由 T1到T2,ΔS減小
D.處于A點的反應體系從T1變到T2,達到平衡時![]() 增大
增大
③在T1溫度時,將1.00molCO和2.00molH2充入1.00L恒容密閉容器中,充分反應達到平衡后,若容器內氣體的壓強減小到開始時的一半,此時CO的轉化率為______________,平衡常數為________________。(填計算結果)
(2)在一個恒容的密閉容器中發生反應CO(g)+2H2(g) ![]() CH3OH(g),在不同時間測定的各成分物質的量濃度如下表:
CH3OH(g),在不同時間測定的各成分物質的量濃度如下表:
時間 | 濃度(mol/L) | ||
c(CO) | c(H2) | c(CH3OH) | |
第0 min | 4.0 | 8.0 | 0 |
第10min | 3.8 | 7.6 | 0.2 |
第20min | 3.4 | 6.8 | 0.6 |
第30min | 3.4 | 6.8 | 0.6 |
第40min | 3.9 | 7.8 | 0.1 |
① CO的平均反應速率v(0min~10min)/ v(10min~20min)=________________。
② 若在第30min時改變了反應條件,改變的反應條件可能是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列措施符合“綠色化學”思想的是( )
A.直接排放含磷生活污水
B.大量使用氟里昂作為冰箱制冷劑
C.使用可降解塑料代替不可降解塑料
D.使用化學性質穩定、不易分解的有機氯農藥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com