
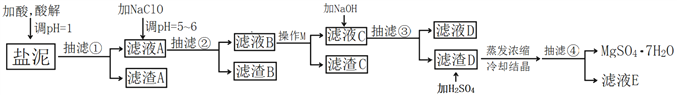
【題目】工業上利用氯堿工業中的固體廢物鹽泥(主要成分為Mg(OH)2、CaCO3、BaSO4,除此之外還有NaCl、Al(OH)3、Fe(OH)3、Mn(OH)2等。)與廢稀硫酸反應制備七水硫酸鎂,產率高,既處理了三廢,又有經濟效益。其工藝流程如下:
已知:
i)部分陽離子以氫氧化物形式完全沉淀時溶液的pH
沉淀物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH值(完全沉淀) | 10.02 | 8.96 | 3.20 | 4.70 | 11.12 |
ii)兩種鹽的溶解度圖(單位為g/100g水)

根據以上流程圖并參考表格pH數據和溶解度圖,請回答下列問題。
(1)酸解時,加入的酸為____________,在酸解過程中,想加快酸解速率,請提出兩種可行的措施____________、____________。
(2)加入的NaClO可與Mn2+反應產生MnO2沉淀,該反應的離子方程式是____________。
(3)本工藝流程多次用到抽濾操作,其優點在于____________,四次抽濾時:抽濾①所得濾渣A的成分為____________、CaSO4;抽濾②所得濾渣B的成分為MnO2、____________、____________;抽濾③所得濾液C中主要雜質陽離子的檢驗方法是____________;抽濾④將產品抽干。
(4)依據溶解度曲線,操作M應采取的方法是適當濃縮,____________。
(5)每制備1噸MgSO4·7H2O,需要消耗鹽泥2噸。若生產過程中的轉化率為70%,則鹽泥中鎂(以氫氧化鎂計)的質量分數約為____________。
【答案】 硫酸 升溫 把鹽泥粉碎、攪拌等 Mn2++ ClO-+ H2O == MnO2↓ + 2H++ Cl- 速度快 BaSO4 Fe(OH)3 Al(OH)3 焰色反應 趁熱過濾 16.8%(16%、17%均可給分)
【解析】(1)因最終產物為MgSO4·7H2O,所以酸解時應加入硫酸,為加快酸解速率,可采用粉碎、攪拌或適當加熱等措施。
(2)已知NaClO可與Mn2+反應產生MnO2沉淀,根據化合價變化規律,則ClO—轉化為Cl—,所以反應的離子方程式為Mn2++ ClO-+ H2O == MnO2↓ + 2H++ Cl-。
(3)抽濾操作的優點是過濾速率快;在強酸性條件下過濾得濾渣A,所以其主要成分為BaSO4和CaSO4;在pH=5~6的條件下過濾得濾渣B,根據氫氧化物沉淀完全的pH可知:濾渣B的主要成分為Al(OH)3、Fe(OH)3、MnO2;濾液C中的主要成分為Na2SO4、MgSO4 和少量的CaSO4,其主要雜質陽離子為Na+,可用焰色反應檢驗。
(4)依據溶解度曲線,CaSO4在40℃左右溶解度最大,在80℃左右溶解度最小,所以操作M應采取的方法適當濃縮、趁熱過濾,盡可能多的除去CaSO4。
(5)根據鎂元素守恒可得:n(MgSO4·7H2O)= n[Mg(OH)2],所以鹽泥中Mg(OH)2的質量分數為= 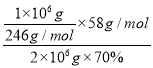 ×100%=16.8%
×100%=16.8%


科目:高中化學 來源: 題型:
【題目】有資料顯示過量的 NH3 和 Cl2 在常溫下可合成巖腦砂(主要成分為 NH4Cl),某實驗小組對該反應進行探究,并對巖腦砂進行元素測定,回答下列問題:
(1)巖腦砂的制備
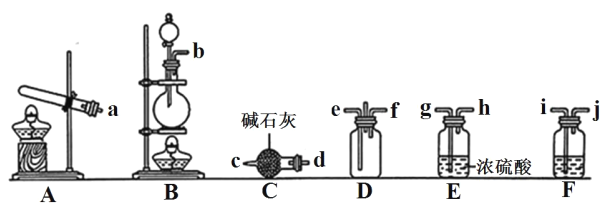
①利用裝置 A 制取實驗所需的 NH3,寫出反應的化學方程式:_______。
②已知該實驗中用濃鹽酸與 MnO2 反應制取所需 Cl2,裝罝 F中的試劑是飽和食鹽水,則 F裝置的作用是_______。
③為了使NH3和Cl2在D中充分混合,請確定上述裝置的合理連接順序:_______→e f←_______(用小寫字母和箭頭表示,箭頭方向與氣流方向一致)。
④證明NH3和Cl2反應有巖腦砂生成,需要用到的實驗用品中除了蒸餾水、稀 HNO3、 紅色石蕊試紙外,還需要用到的試劑有_______。(填試劑的化學式)
(2)巖腦砂中元素的測定
準確稱取 a g 巖腦砂,與足量的氧化銅混合加熱,利用下列裝置測定巖腦砂中氮元素和氯元素的物質的量之比。(已知該過程發生的反應為:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O)
3Cu+N2↑+2HCl↑+3H2O)
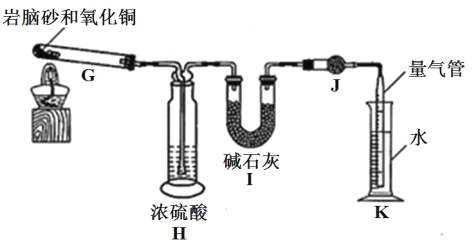
⑤設置裝置 H 的目的是______。
⑥若裝置 I 增重 b g,利用裝置 K 測得氣體體積為 V L(已知常溫常壓下的氣體摩爾體積為 24.5L·mol-1),則巖腦砂中 n(N):n(Cl)= ______(用含 b、V的代數式表示,不必化簡)。
⑦若測量體積時氣體溫度高于常溫(其他操作均正確),則 n(N)比正常值______ (填“偏高”“偏低”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
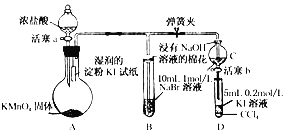
【題目】(實驗題)為驗證鹵素單質氧化性的相對強弱,某小組用下圖所示裝置進行實驗(夾持儀器已略去,氣密性已檢驗)
實驗過程:
Ⅰ.打開彈簧夾,打開活塞a,滴加濃鹽酸
Ⅱ.當B和C中的溶液都變為黃色時,夾緊彈簧夾
Ⅲ.當B中溶液由黃色變為棕紅色時,關閉活塞a
Ⅳ.……
(1)A中產生黃綠色氣體,其電子式是____________________
(2)驗證氯氣的氧化性強于碘的實驗現象是____________________
(3)B中溶液發生反應的離子方程式是____________________
(4)為驗證溴的氧化性強于碘,過程Ⅳ的操作和現象是__________________________________________
(5)過程Ⅲ實驗的目的是____________________
(6)氯溴碘單質的氧化性逐漸減弱的原因:同主族元素從上到下_________,得電子能力逐漸減弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,向aL密閉容器中加入1molX氣體和2molY氣體,發生如下反應:X(g)+2Y(g)![]() 2Z(g),此反應達到平衡的標志是
2Z(g),此反應達到平衡的標志是![]()
A. 容器內壓強不隨時間變化
B. v正(X) =v逆(Z)
C. 容器內X、Y、Z的濃度之比為l:2:2
D. 單位時間內消耗0.1molX的同時生成0.2molZ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】木炭、活性炭、炭黑、焦炭是由石墨的微小晶體和少量雜質構成的,均屬混合物。沒有固定的幾何外形,所以稱為無定形碳,在工業上有著重要用途。回答下列問題:
(1)木炭與硫黃、火硝(硝酸鉀)按一定比例混合即為黑火藥。黑火藥爆炸時生成硫化鉀、氮氣和二氧化碳。黑火藥爆炸的化學方程式為____________。若有15g木炭參加反應,轉移電子數為____________。
(2)工業上的炭黑是由烴類裂解而制得的高度分散性的黑色粉末狀物質。
①已知幾個反應的熱化學方程式:
C(s)+O2 (g)CO2(g) ΔH1=393.5 kJmol1
2H2(g)+O2 (g)2H2O(1) ΔH2=571.6 kJmol1
CH4(g)+2O2(g)CO2(g)+ 2H2O(1) ΔH3=890.3 kJmol1
則由天然氣生產炭黑的熱化學方程式為____________。
②右圖是溫度對天然氣生產炭黑轉化率的影響,下列有關說法正確的是____________。
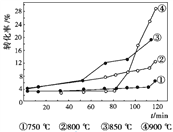
A. 甲烷裂解屬于吸熱反應
B. 增大體系壓強,能提高甲烷的轉化率
C. 在反應體系中加催化劑,反應速率增大
D. 升高溫度,該反應的平衡常數減小
(3)活性炭可以用來凈化氣體和液體。
①用活性炭還原氮氧化物,可防止空氣污染。向1 L密閉容器加入一定量的活性炭和NO,某溫度下發生反應C(s)+ 2NO(g)![]() N2(g)+CO2(g),測得不同時間內各物質的物質的量如下表:
N2(g)+CO2(g),測得不同時間內各物質的物質的量如下表:
物質的量/mol 時間/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此溫度下,該反應的平衡常數K=____________ (保留兩位小數)。10~20min內,NO的平均反應速率為____________;若30 min后升高溫度,達到新平衡時,容器中c(NO)∶c(N2)∶c(CO2)=2∶1∶1,則該反應的ΔH____________0(填“>”、“<”或“=”)。
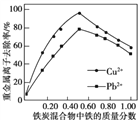
②活性炭和鐵屑混合可用于處理水中污染物。在相同條件下,測量總質量相同、鐵的質量分數不同的鐵炭混合物對水中span>Cu2+和Pb2+的去除率,結果如圖所示。當混合物中鐵的質量分數為0時,也能去除水中少量的Cu2+和Pb2+,其原因是____________;當混合物中鐵的質量分數大于50%時,隨著鐵的質量分數的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組選用以下裝置進行實驗設計和探究(圖中a、b、c均為止水夾):
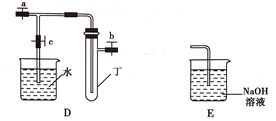
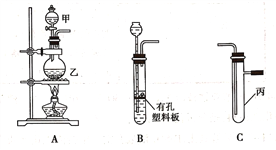
(1)在進行氣體制備時,應先檢驗裝置的氣密性。將A裝置中導管末端密封后,在分液漏斗甲內裝一定量的蒸餾水,然后__________________________________________,則證明A裝置的氣密性良好。
(2)利用E裝置能吸收的氣體有__________________________________(任寫兩種即可)。
(3)用鋅粒和稀硫酸制備H2時應選用裝置________作為發生裝置(填所選裝置的字母序號),實驗時先在稀硫酸中加入少量硫酸銅晶體可使反應速率加快,原因是___________________________。
(4)某同學將A、C、E裝置連接后設計實驗比較Cl-和S2-的還原性強弱。
①A中玻璃儀器乙的名稱為______________________,A裝置中發生反應的離子方程式為
_____________________________________________。
②C中說明Cl-和S2-的還原性強弱的實驗現象是_______________________________________。
(5)另一同學將B、D、E裝置連接后,在B裝置中加入銅片和濃硝酸,制取NO2,然后進行NO2氣體與水反應的實驗,并觀察相關現象:
①B裝置中發生反應的離子方程式為________________________________________________。
②反應一段時間后D裝置中的具支試管丁中收集滿NO2氣體,若進行NO2氣體與水反應的實驗,應____________________________________(填對a、b、c三個止水夾進行的操作),然后再適當加熱丁。實驗現象為____________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳循環(如圖)對人類生存、發展有著重要的意義。下列說法錯誤的是
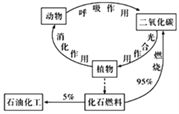
A. 碳是構成有機物的主要元素
B. 石油的年產量是一個國家石油化工發展水平的標志
C. 化石燃料的大量燃燒是產生溫室效應的原因之一
D. 光合作用是將太陽能轉化為化學能的過程
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組通過下列裝置探究MnO2與FeCl3·6H2O能否反應產生Cl2。
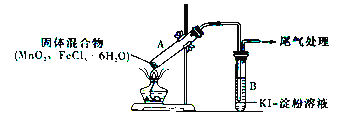
實驗操作和現象如下表所示:
實驗編號 | 操作 | 現象 |
實驗1 | 按上圖所示裝置加熱MnO2與FeCl3·6H2O混合物 | ①試管A中部分固體溶解,上方出現白霧 ②稍后,產生黃色氣體,管壁附著黃色液滴 ③試管B中溶液變藍 |
實驗2 | 把試管A中的混合物換為FeCl3·6H2O,試管B中溶液換為KSCN溶液,加熱 | 試管A中部分固體溶解,產生白霧和黃色氣體;試管B中KSCN溶液變紅 |
請回答下列問題:
(1)實驗1和實驗2 產生白霧的原因是_____________________________。
(2)實驗2說明黃色氣體中含有_____________(填化學式)。
(3)為進一步確認黃色氣體中是否含有Cl2,該學習小組對實驗1提出兩種改進方案:
方案1:在試管A、B間增加盛有某種試劑的洗氣瓶C,結果試管B 中溶液仍變為藍色。
方案2:將試管B中KI-淀粉溶液替換為NaBr溶液,結果試管B 中溶液呈橙紅色,且未檢出Fe2+。則方案1中洗氣瓶C 中盛放的試劑是_________;方案2 中檢驗Fe2+的試劑的名稱是______,選擇NaBr溶液后試管B中發生的主要反應的離子方程式為______________________________________。
(4)實驗1充分加熱后,若將試管A中產物分離得到Fe2O3 和MnCl2,則試管A 中產生Cl2 的化學方程式為__________________________________________。其尾氣處理的方法是_______________________。
(5)該學習小組認為實驗1中溶液變藍,可能還有另外一種原因是__________________。請你設計實驗方案驗證此猜想_______________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com