
【題目】甲~辛等元素在周期表中的相對位置如下表。甲與戊的原子序數相差3,戊的一種單質是自然界硬度最大的物質,丁與辛屬同周期元素,下列判斷正確的是( )
![]()
A.金屬性:甲>乙>丁
B.原子半徑:辛>己>戊
C.丙與庚的原子核外電子數相差3
D.乙的單質在空氣中燃燒生成只含離子鍵的化合物
【答案】B
【解析】
戊的一種單質(金剛石)是自然界硬度最大的物質,則戊為C,甲與戊的原子序數相差3,則甲的原子序數為6-3=3,即甲為Li,由元素在周期表中的相對位置圖可知,乙為Na,丙為K,丁為Ca;丁與辛屬同周期元素,由第ⅣA族元素可知,己為Si,庚為Ge,辛為Ga,據此判斷。
A.同主族,從上到下金屬性增強;同周期,從左向右金屬性減弱,則金屬性甲<乙<丁,A錯誤;
B.電子層越多,半價越大;同主族從上到下原子半徑增大,則原子半徑為辛>己>戊,B正確;
C.原子序數等于核外電子數,丙(原子序數為19)與庚(原子序數為32)的原子核外電子數相差32-19=13,C錯誤;
D.乙的單質在空氣中燃燒生成Na2O2,為含離子鍵和非極性共價鍵的化合物,D錯誤;
答案選B。


科目:高中化學 來源: 題型:
【題目】某化學興趣小組以黃銅礦(主要成分CuFeS2)為原料進行如下實驗探究.為測定黃銅礦中硫元素的質量分數,將m1g該黃銅礦樣品放入如圖所示裝置中,從a處不斷地緩緩通入空氣,高溫灼燒石英管中的黃銅礦樣品.

(1)錐形瓶A內所盛試劑是__________;裝置B的作用是__________;錐形瓶D內發生反應的離子方程式為__________。
(2)反應結束后將錐形瓶D中的溶液進行如下處理:

如圖則向錐形瓶D中加入過量H2O2溶液反應的離子方程式為__________;操作Ⅱ是洗滌、烘干、稱重,其中洗滌的具體方法__________;該黃銅礦中硫元素的質量分數為__________(用含m1、m2的代數式表示).
(3)反應后固體經熔煉、煅燒后得到泡銅(Cu、Cu2O)和熔渣(Fe2O3、FeO),要驗證熔渣中存在FeO,應選用的最佳試劑是__________
A.KSCN溶液、氯水B.稀鹽酸、KMnO4溶液
C.稀硫酸、KMnO4溶液D.NaOH溶液
(4)已知:Cu+在強酸性環境中會發生反應生成Cu和Cu2+.設計實驗方案驗證泡銅中是否含有Cu2O__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將碘水中的碘萃取出來的實驗中,下列說法錯誤的是 ( )
A. 分液漏斗使用前要檢查它是否漏水
B. 酒精比水更容易使碘溶解,酒精可以做萃取劑
C. 注入碘水和萃取劑,倒轉分液漏斗反復用力振蕩后,靜置,分液
D. 分液時,下層液體應從下口流出,上層液體應從上口倒出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學學科理論和實踐的發展遵循其內在規律,在相近的知識體系間有著密切關聯性。
I.分析下列有關電化學裝置圖
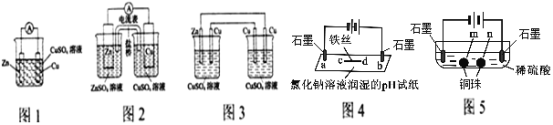
(1)圖2裝置原電池相比圖1裝置原電池可獲得較長時間的穩定的電流,原因是_________________________________。
(2)將圖2裝置中CuSO4溶液為電解質溶液,鹽橋用銅導線代替后變為圖3裝置,該裝置從左到右電極名稱依次是_________________________________。
(3)圖4裝置中d處電極反應式為:______________________。
(4)根據相同原理,圖5裝置中兩個石墨電極附近有氣泡產生,___________處能析出銅。
Ⅱ·溫室效應使地球變曖成為人類社會急需解決的重要環境問題。研究表明,在 Cu/ZnO催化劑存在下,H2可還原CO2,發生如下兩個平行反應:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
相同投料和壓強下,經過相同反應時間測得如下實驗數據:

注:M--Cu/ZnO納米棒;N--Cu/ZnO納米片;甲醇選擇性:轉化的CO2中生成甲醇的百分比
已知:①CO和H2的標準燃燒熱分別為-283.0 kJ·mol-1和-285.8 kJ ·mol-1
②H2O(l)=H2O(g) △H3=+44.0 kJ·mol-1,請回答(不考慮溫度對△H的影響):
(1)有利于生成甲醇反應的平衡常數表達式K=______________。
(2)提高CO2轉化為CH3OH平衡轉化率的措施有___________。
A.使用催化劑M B.使用催化劑N
C.降低反應溫度 D.投料比不變,增加反應物的濃度
E.增大CO2和H2的初始投料比
(3)表中實驗數據表明,在相同溫度下不同的催化劑對CO2轉化成CH3OH的選擇性有顯著的影響,其原因是____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在相同條件下,0.1mol鎂和0.1mol鋁分別和足量的稀鹽酸起反應后產生的氫氣的質量
A. 鎂產生的多 B. 鋁產生的多 C. 鎂和鋁產生的一樣多 D. 無法比較
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,可用離子方程式![]() +
+![]() =
=![]() 表示的是
表示的是
A.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl=MgCl2+2H2O
C.![]()
D.![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列物質①H2O,②CuO,③CuSO4,④NaOH,⑤氨水,其中屬于氧化物的是__________,(請填序號,下同)屬于鹽的是__________,屬于混合物的是__________,屬于電解質的是__________。
(2)在氮的化合物中,紅棕色、有刺激性氣味的有毒氣體是__________,(填寫化學式)
(3)根據反應 MnO2+4HCl(濃) ![]() MnCl2+Cl2↑+2H2O,回答下列問題:還原劑是__________,還原產物是__________,氧化劑是__________,氧化產物是__________。
MnCl2+Cl2↑+2H2O,回答下列問題:還原劑是__________,還原產物是__________,氧化劑是__________,氧化產物是__________。
(4)純凈的H2在Cl2中燃燒發出__________色火焰。
(5)金屬鈉切開后,光亮的金屬斷面__________,說明常溫下鈉能夠跟__________反應,生成__________;鈉投入水中,鈉__________水面上,并四處游動,發出響聲,這說明__________,熔成一個閃亮的小球,最后向燒杯中滴加酚酞,溶液__________。
(6)配平:①_____HNO3(稀)+____Cu=_____Cu(NO3)2+____H2O+ NO↑
②___H2SO4(濃)+_____C![]() _____CO2↑+_____SO2↑+_____H20
_____CO2↑+_____SO2↑+_____H20
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某元素 R 的最高價氧化物的水化物分子式是 HnRO2n﹣2,則在氣態氫化物中 R 元素的化合價是( )
A.3n﹣10B.12﹣3nC.3n﹣4D.3n﹣12
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com