
【化學——選修3:物質結構與性質】
鹵族元素的單質和化合物很多,我們可以利用所學物質結構與性質的相關知識去認識和理解它們。
(1)鹵族元素位于周期表的_________區;溴的價電子排布式為_________________。
(2)請根據下表提供的第一電離能數據判斷:最有可能生成較穩定的單核陽離子的鹵素原子是_________。
氟 | 氯 | 溴 | 碘 | 鈹 | |
第一電離能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(3)已知高碘酸有兩種形式,分別為H5IO6(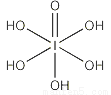 )和HIO4,前者為五元酸,后者為一元酸。請比較二者酸性強弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者為五元酸,后者為一元酸。請比較二者酸性強弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
(4)與KI3類似的,還有CsICl2等。已知CsICl2不穩定,受熱易分解,傾向于生成晶格能更大的物質,則它按下列_____式發生。
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(5)已知ClO2-為角型,中心氯原子周圍有四對價層電子。ClO2-中心氯原子的雜化軌道類型為___________,與ClO2-互為等電子體的微粒是__________。(任寫一個)
(6)右圖為碘晶體晶胞結構。有關說法中正確的是_________。
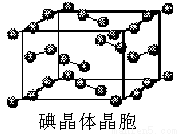
A.碘分子的排列有2種不同的取向,2種取向不同的碘分子以4配位數交替配位形成層結構
B.用均攤法可知平均每個晶胞中有4個碘原子
C.碘晶體為無限延伸的空間結構,是原子晶體
D.碘晶體中的碘原子間存在非極性鍵和范德華力
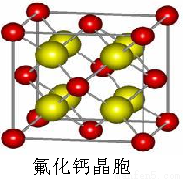
(7) 已知CaF2晶體(見右圖)的密度為ρg/cm3,NA為阿伏加德羅常數,相鄰的兩個Ca2+的核間距為a cm,則CaF2的相對分子質量可以表示為___________。
科目:高中化學 來源:2016屆吉林省高三第二次模擬理綜化學試卷(解析版) 題型:選擇題
科學家開發出一種新型鋰—氧電池,能量密度極高,效率達90%以上。電池中添加碘化鋰(LiI)和微量水,工作原理如圖,總反應為:O2+4LiI+2H2O 2I2+4LiOH。對于該電池的說法不正確的是
2I2+4LiOH。對于該電池的說法不正確的是
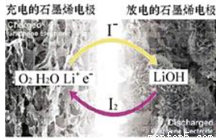
A.放電時負極上I-被氧化
B.充電時Li+從陽極區移向陰極區
C.充電時陰極反應為LiOH+e-= Li+OH-
D.放電時正極反應為O2+2H2O+4Li++4e-= 4LiOH
查看答案和解析>>
科目:高中化學 來源:2015-2016學年寧夏六盤山高中高一下期中化學試卷(解析版) 題型:選擇題
下列說法正確的是
A.某微粒核外電子排布為2、8、8結構,則該微粒一定是氬原子
B.Na+的半徑大于F-的半徑
C.F-,Na+,Mg2+,Al3+是與He原子具有相同電子層結構的離子
D.NH4+與H3O+具有相同的質子數和電子數
查看答案和解析>>
科目:高中化學 來源:2016屆海南海南中學高三考前模擬十一化學試卷(解析版) 題型:選擇題
已知常溫下Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5×10-13,下列有關說法錯誤的是
A.相同溫度時,兩種飽和溶液中:c(Cl-)≈19c(Br-)
B.AgCl、AgBr組成的混合溶液中:c(Cl-)>c(Br-)
C.向飽和AgCl溶液中通入HCl后有沉淀生成,但溶液中c(Cl-)增大
D.AgBr在水中溶解度及Ksp均比在NaBr溶液中的大
查看答案和解析>>
科目:高中化學 來源:2016屆海南海南中學高三考前模擬十一化學試卷(解析版) 題型:選擇題
25℃時,0.1mol/LMOH溶液的pH約為11,該溶液與0.1mol/L的硫酸溶液混合生成1molM2SO4時放出的熱量為24.6kJ,又知稀硫酸的中和熱為57.3kJ/mol,則MOH電離時的△H為
A.+45kJ/mol
B.+32.7kJ/mol
C.-45kJ/mol
D.無法計算
查看答案和解析>>
科目:高中化學 來源:2016屆陜西省高三第五次適應性考試理綜化學試卷(解析版) 題型:選擇題
向溶液中分別通入足量的相應氣體后,下列各組離子還能大量存在的是
A.氯氣:K+、Na+、SiO32-、NO3- B.二氧化硫:Na+、NH4+、SO32-、C1-
C.乙烯:H+、K+、MnO4-、SO42- D.氨氣:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化學 來源:2015-2016學年內蒙古包頭九中高一下第一次月考化學試卷(解析版) 題型:實驗題
某同學對SO2與漂粉精的反應進行實驗探究:
操作 | 現象 |
取4 g漂粉精固體,加入100 mL水 | 部分固體溶解,溶液略有顏色 |
過濾,測漂粉精溶液的pH | pH試紙先變藍(約為12),后褪色 |
| (1)溶液出現渾濁,并變為黃綠色;(2)稍后,產生大量白色沉淀,黃綠色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化學方程式是 ________________________________。
(2)pH試紙顏色的變化說明漂粉精溶液具有的性質是__________________________。
(3)現象(1)中溶液變為黃綠色的可能原因:隨溶液酸性的增強,漂粉精的有效成分ClO-和Cl-發生反應。通過進一步實驗確認了這種可能性,其實驗方案是_____________________。并寫出漂白精有效成分ClO-和Cl-反應的離子方程式: 。
(4)將A瓶中混合物過濾、洗滌,得到沉淀X
①向沉淀X中加入稀HCl,無明顯變化。取上層清液,加入BaCl2溶液,產生白色沉淀。則沉淀X中含有的物質是 。
②用離子方程式解釋現象(2)中黃綠色褪去的原因: 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年內蒙古包頭九中高一下第一次月考化學試卷(解析版) 題型:選擇題
現有下列五個轉化,其中不可能通過一步反應實現的是
①SiO2→Na2SiO3;②CuSO4→CuCl2;③SiO2→H2SiO3 ;④CuO→Cu(OH)2;⑤Na2O2→NaOH.
A.①② B.③④ C.②③④ D.②③④⑤
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高一下期中化學試卷(解析版) 題型:選擇題
科學家預言,298114F1將是最穩定的同位素,該同位素原子的中子數和質子數之差是
A.70 B.114 C.184 D.289
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com