
MnO2、KMnO4等是中學化學中的常用試劑。請回答下列問題:
(1)MnO2在H2O2分解反應中作催化劑。若將MnO2加入酸化的H2O2溶液中,MnO2 溶解產生Mn2+,反應的離子方程式是??????????????????????????????????????????????? 。
(2)用MnO2制KMnO4的工藝流程如圖

電解池中兩極材料均為碳棒,在水或酸性溶液中K2MnO4發生歧化而變成MnO2和KMnO4。
①寫出240℃熔融時發生反應的化學方程式????????????????????????????????????? ,投料時必須滿足n(KOH):n(MnO2) ?????????? 。
②陽極的電極反應為??????????????????????????????????? 。
③B物質是????????? (寫化學式,下同),可以循環使用的物質是???????????????????? 。
④鉀離子交換膜的一種材料是聚丙烯酸鉀( ),聚丙烯酸鉀單體的結構簡式為??????????? 。
),聚丙烯酸鉀單體的結構簡式為??????????? 。
⑤上述制得的KMnO4產品0.165 g,恰好與0.335 g經硫酸酸化的Na2C2O4反應完全,該KMnO4的
純度是??????????? (精確到0.1%)。
(1)MnO2 + 2H+ + H2O2 = Mn2+ + O2 ↑+ 2H2O
(2)① 2MnO2 + O2 + 4KOH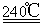 2K2MnO4 + 2H2O? ,大于(或 >)2 : 1
2K2MnO4 + 2H2O? ,大于(或 >)2 : 1
② MnO42- - e- = MnO4-?? ???? ③ H2,KOH固體???? ④ CH2=CHCOOK???? ⑤ 95.8%????
【解析】
試題分析:(1)根據題意,結合電荷守恒、原子守恒、電子守恒,可得方程式為:MnO2 + 2H+ + H2O2 = Mn2+ + O2 ↑+ 2H2O。(2)①在240℃熔融時MnO2、O2、KOH發生氧化還原反應,根據質量守恒定律和電子守恒的知識可知發生該反應的化學方程式為:2MnO2 + O2 + 4KOH? 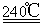 2K2MnO4 + 2H2O。由方程式可知在投料時必須滿足n(KOH):n(MnO2)=2:1,為了使MnO2充分發生反應,KOH必須過量。因此二者的物質的量的比要大于2:1. ②由題意知道K2MnO4應該在陽極發生氧化反應,失去電子,被氧化為KMnO4 。所以陽極的電極反應為MnO42- - e- = MnO4- 。③在陰極發生反應:2H2O+2e-=H2↑+2OH-.所以B物質是 H2。根據電極反應式可以看出在此過程中可以循環的物質為KOH。④鉀離子交換膜的一種材料是聚丙烯酸鉀 。該物質為丙烯酸鉀發生加聚反應得到的,其結構簡式為 CH2=CHCOOK。⑤Na2C2O4與酸性KMnO4溶液發生反應的方程式為:5Na2C2O4+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4 +10CO2↑+8H2O。n(Na2C2O4)=0.335 g÷134g/mol=0.0025mol;則根據反應方程式可知消耗的KMnO4的物質的量為0.0025mol×2/5=0.001mol.其質量為0.001mol×158g/mol=0.158g.所以該KMnO4的純度是0.158g÷0.165 g×100%=95.8%.
2K2MnO4 + 2H2O。由方程式可知在投料時必須滿足n(KOH):n(MnO2)=2:1,為了使MnO2充分發生反應,KOH必須過量。因此二者的物質的量的比要大于2:1. ②由題意知道K2MnO4應該在陽極發生氧化反應,失去電子,被氧化為KMnO4 。所以陽極的電極反應為MnO42- - e- = MnO4- 。③在陰極發生反應:2H2O+2e-=H2↑+2OH-.所以B物質是 H2。根據電極反應式可以看出在此過程中可以循環的物質為KOH。④鉀離子交換膜的一種材料是聚丙烯酸鉀 。該物質為丙烯酸鉀發生加聚反應得到的,其結構簡式為 CH2=CHCOOK。⑤Na2C2O4與酸性KMnO4溶液發生反應的方程式為:5Na2C2O4+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4 +10CO2↑+8H2O。n(Na2C2O4)=0.335 g÷134g/mol=0.0025mol;則根據反應方程式可知消耗的KMnO4的物質的量為0.0025mol×2/5=0.001mol.其質量為0.001mol×158g/mol=0.158g.所以該KMnO4的純度是0.158g÷0.165 g×100%=95.8%.
考點:考查化學方程式、離子方程式的書寫、電解池的化學反應原理、聚合物與單體的相互轉化、物質的轉化率的計算的知識。


科目:高中化學 來源: 題型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:


| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com