
【題目】將13.6gCu和Cu2O組成的混合物加入250 mL—定濃度的稀硝酸中,固體完全溶解生成Cu(NO3)2和NO。向所得溶液中加入1.0 L 0.5 mol L-1的NaOH溶液,生成沉淀的質量為19.6 g,此時溶液呈中性,且金屬離子(鈉離子除外)沉淀完全。下列說法正確的是
A. 原固體混合物中,Cu和Cu2O的物質的量之比為1:1
B. 原稀硝酸的濃度為1.3 mol·L-1
C. 固體溶解后剩余硝酸的物質的量為0.1 mol
D. 產生的NO的體積為2.24L
【答案】C
【解析】
向所得溶液中加入0.5mol/L 的NaOH溶液1L,溶液呈中性,金屬離子已完全沉淀,此時溶液中溶質為NaNO3,n(NaNO3)=n(NaOH)=0.5mol/L×1L=0.5ml,沉淀為Cu(OH)2,質量為19.6g,其物質的量為:![]() =0.2mol,根據銅元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反應后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.2mol,
=0.2mol,根據銅元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反應后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.2mol,
A.設Cu和Cu2O的物質的量分別為xmol、ymol,根據二者質量有 64x+144y=13.6,根據銅元素守恒有x+2y=0.2,聯立方程解得x=0.1,y=0.05,則:n(Cu):n(Cu2O)=0.1mol:0.05mol=2:1,故A錯誤;
B.根據選項N元素守恒可知n(HNO3)=n(NO)+n(NaNO3),根據電子轉移守恒可知:3n(NO)=2n(Cu)+2n(Cu2O),所以3n(NO)=2×0.1mol+2×0.05mol,解得n(NO)=0.1mol,根據Na元素可知n(NaNO3)=n(NaOH)=0.5mol/L×1L=0.5mol,所以n(HNO3)=n(NO)+n(NaNO3)=0.1mol+0.5mol=0.6mol,所以原硝酸溶液的濃度為:![]() =2.4mol/L,選項B錯誤;
=2.4mol/L,選項B錯誤;
C.反應后的溶液中加入氫氧化鈉溶液,部分氫氧化鈉與硝酸銅反應,部分氫氧化鈉與硝酸反應,最后為硝酸鈉溶液,根據氮元素守恒可知反應后溶液中n(HNO3)+2n[[Cu(NO3)2]=n(NaNO3),所以n(HNO3)=n(NaNO3)-2n[[Cu(NO3)2]=0.5mol-2×0.2mol=0.1mol,選項C正確;
D.由B中計算可知n(NO)=0.1mol,所以標準狀況下NO的體積為:0.1mol×22.4L/mol=2.24L,選項D錯誤;
答案選C。


科目:高中化學 來源: 題型:
【題目】由下列實驗及現象不能推出相應結論的是
選項 | 實驗 | 現象 | 結論 |
A | 向添有KIO3的食鹽中加入淀粉溶液、稀鹽酸及KI | 溶液變藍色 | 氧化性:IO |
B | 向稀氨水和酚酞混合溶液中加入少量Ag2O,振蕩 | 溶液由淺紅色變為紅色 | Ag2O是強堿 |
C | 向裝有經過硫酸處理的CrO3(桔紅色)的硅膠導管中吹入乙醇蒸氣 | 固體逐漸由桔紅色變為淺綠色(Cr3+) | 乙醇具有還原性 |
D | 向盛有少量水的燒杯中加入少量Mg2Si | 產生白色沉淀,液面上有火苗 | Mg2Si水解生成Mg(OH)2和SiH4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】艾司洛爾是預防和治療手術期心動過速或高血壓的一種藥物,艾司洛爾的一種合成路線如下:
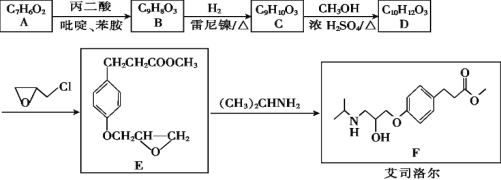
回答下列問題:
(1)丙二酸的結構簡式為_______;E中含氧官能團的名稱是_______。
(2)D生成E的反應類型為____________。
(3)C的結構簡式為________________。
(4)A遇FeCl3溶液發生顯色反應,1 mol A和1 mol丙二酸在吡啶、苯胺中反應生成1 mol B、1 mol H2O和1 mol CO2,B能與溴水發生加成反應,推測A生成B的化學方程式為____。
(5)X是B的同分異構體,X同時滿足下列條件的結構共有____種,其中核磁共振氫譜有五組峰的結構簡式為____。
①可與碳酸氫鈉溶液反應生成二氧化碳
②遇FeCl3溶液發生顯色反應
③除苯環外不含其他環
(6)寫出以苯甲醇和丙二酸為原料制備![]() 的合成路線________(其他試劑任選)。
的合成路線________(其他試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在一個2 L的密閉容器中,X、Y、Z三種物質的物質的量隨時間的變化曲線如圖所示。根據圖中數據,試填寫下列空白:
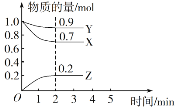
(1)該反應的化學方程式為_______________。
(2)反應開始至2 min,以氣體Z表示的平均反應速率為________。
(3)可以判斷上述反應已經達到平衡的是________。
A.v(A)∶v (B)∶v (C)等于化學計量數之比
B.密閉容器中總壓強不變 C.密閉容器中混合氣體的密度不變
D.混合氣體的平均相對分子質量不再改變 E.n(A)∶n(B)∶n(C)等于化學計量數之比
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于下圖所示轉化關系(X代表鹵素),說法不正確的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途徑Ⅰ生成HX的反應熱與途徑無關,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金屬性依次減弱,所以途徑Ⅱ吸收的熱量依次增多
D.途徑Ⅰ生成HCl放出的熱量比生成HBr的多,說明HCl比HBr穩定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下圖所示實驗裝置(夾持儀器已略去)探究銅絲與過量濃硫酸的反應。下列實驗不合理的是 ( )

A. ③中選用NaOH溶液吸收多余的SO2
B. 上下移動①中銅絲可控制SO2的量
C. ②中選用品紅溶液驗證SO2的生成
D. 為確認CuSO4生成,向①中加水,觀察顏色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】大氣污染越來越成為人們關注的問題,煙氣中的NOx必須脫除(即脫硝)之后才能排放。
(1)在汽車尾氣系統中裝置催化轉化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.0 kJ·mol1
2NO(g) ΔH=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列問題:
①CO的燃燒熱ΔH為 _________。若1 mol N2(g)、1 mol O2(g) 分子中化學鍵斷裂時分別需要吸收946 kJ、498 kJ的能量,則1 mol NO(g) 分子中化學鍵斷裂時需吸收的能量為_________kJ。
②CO將NO2還原為單質的熱化學方程式為 ________________。
(2)圖是一種用NH3脫除煙氣中NO的原理。
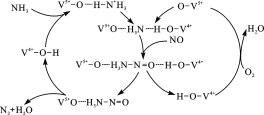
①該原理中,NO最終轉化為H2O和_______(填化學式)。
②當消耗1 mol NH3和0.5 mol O2時,除去的NO在標準狀況下的體積為____L。
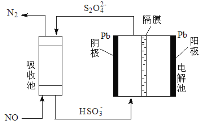
(3)間接電化學法,如圖所示。已知電解池的陰極室中溶液的pH在4~7之間,寫出陰極的電極反應式_____________。用離子方程式表示吸收池中除去NO的原理_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼鎂泥是一種工業廢料,主要成份是MgO(占40%,質量分數),還有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等雜質,以此為原料制取的硫酸鎂,可用于印染、造紙、醫藥等工業。從硼鎂泥中提取MgSO47H2O的工藝流程如下:
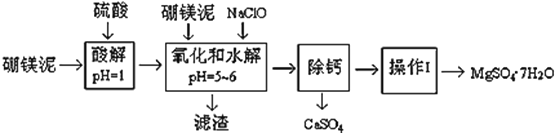
(1)實驗中需要1 mol/L的硫酸800 mL,若用 98% 的濃硫酸(ρ= 1.84 g/mL)來配制,量取濃硫酸需要使用量筒的規格為__________(填寫選項字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可與Mn2+ 反應:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在該步驟中還有一種離子也會被NaClO氧化,該反應的離子方程式為___________________。
(3)濾渣的主要成分除含有Fe(OH)3、Al(OH)3外,還含有__________,___________。
(4)在“除鈣”前,需檢驗濾液中Fe3+ 是否被除盡,簡述檢驗方法___________________。(寫出操作、現象和結論)
(5)已知MgSO4、CaSO4 的溶解度(單位為 g/100 g 水)如下表:
溫度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除鈣”是將MgSO4和CaSO4混合溶液中的CaSO4除去,根據上表數據,簡要說明操作步驟______。“操作Ⅰ”是將濾液繼續蒸發濃縮,冷卻結晶,______,便得到了MgSO47H2O
(6)實驗中提供的硼鎂泥共100 g,得到 MgSO47H2O為172.2 g ,則MgSO47H2O 的產率為___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com