
【題目】某化學小組研究在其他條件不變時,改變密閉容器中某一條件對A2(g)+3B2(g) ![]() 2AB3(g)化學平衡狀態的影響,得到如圖所示的曲線(圖中T表示溫度,n表示物質的量)。下列判斷不正確的是( )
2AB3(g)化學平衡狀態的影響,得到如圖所示的曲線(圖中T表示溫度,n表示物質的量)。下列判斷不正確的是( )
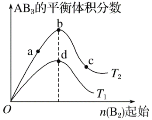
A. 若T2<T1,則正反應一定是放熱反應
B. 在T2和n(A2)不變時達到平衡,AB3的物質的量大小為c>b>a
C. 達到平衡時A2的轉化率大小為b>a>c
D. 若T2<T1,達到平衡時b、d點的反應速率為vd>vb
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
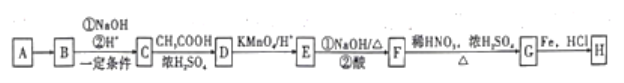
【題目】化合物H(![]() ),是一種常見的抗結腸炎藥物。如圖是利用芳香烴A為原料設計制備H的路線。
),是一種常見的抗結腸炎藥物。如圖是利用芳香烴A為原料設計制備H的路線。
已知:①A蒸氣的密度是相同條件下氫氣密度的46倍;
②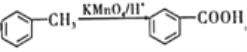 。
。
回答下列問題
(1)A的名稱是_______,C中含有官能團的名稱是____。
(2)寫出C生成D的化學方程式:______,該反應的類型是______。
(3)G的結構簡式是______。
(4)設計C→D和E→F兩步反應的目的是______。
(5)化合物X是D的同分異構體,符合下列條件的X共______種。
①芳香族化合物,且苯環上有兩個取代基②能發生水解反應
寫出其中核磁共振氫譜顯示有4種不同化學環境的氫原子,峰面積之比為3:3:2:2的所有X的結構簡式:______。
(6)已知![]() 易被氧化,苯環上連有烷基時再引入一個取代基,常取代在烷基的鄰、對位,而當苯環上連有羧基時則取代在間位。據此寫出以A為原料制備化合物
易被氧化,苯環上連有烷基時再引入一個取代基,常取代在烷基的鄰、對位,而當苯環上連有羧基時則取代在間位。據此寫出以A為原料制備化合物![]() 的合成路線(無機試劑任選)___________。
的合成路線(無機試劑任選)___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】控制適合的條件,將反應Fe3++AgFe2++Ag+設計成如下圖所示的原電池(鹽橋裝有瓊脂-硝酸鉀溶液;靈敏電流計的0刻度居中,左右均有刻度)。已知接通后,觀察到電流計指針向右偏轉。下列判斷不正確的是( )。
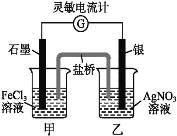
A. 在外電路中,電子從銀電極流向石墨電極
B. 鹽橋中的K+移向甲燒杯
C. 電流計指針居中后,往甲燒杯中加入一定量的鐵粉,電流計指針將向左偏轉
D. 一段時間后,電流計指針反向偏轉,越過0刻度,向左邊偏轉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】偏釩酸銨(NH4VO3)主要用作催化劑、催干劑、媒染劑等。用沉淀法除去工業級偏釩酸銨中的雜質硅、磷的流程如圖:
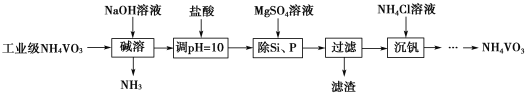
(1)堿溶時,下列措施有利于NH3逸出的是____(填字母序號)。
a.升高溫度 b.增大壓強 c.增大NaOH溶液的濃度
(2)①濾渣的主要成分為Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×10-5,若濾液中c(SiO32-)=0.08mol·L-1,則c(Mg2+)=____。
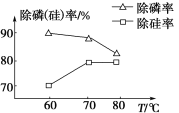
②由圖可知,加入一定量的MgSO4溶液作沉淀劑時,隨著溫度的升高,除磷率下降,其原因是溫度升高,Mg3(PO4)2溶解度增大和促進Mg2+水解生成Mg(OH)2;但隨著溫度的升高,除硅率升高,其原因是____(用離子方程式表示)。
(3)沉釩時,反應溫度需控制在50℃,在實驗室可采取的加熱方式為____。
(4)探究NH4Cl的濃度對沉釩率的影響,設計實驗步驟(常見試劑任選):取兩份10mL一定濃度的濾液A和B,分別加入1mL和10mL的1mol·L-1 NH4Cl溶液,再向A中加入___mL蒸餾水,控制兩份溶液的溫度均為50℃、pH均為8,由專用儀器測定沉釩率,加入蒸餾水的目的是____。
(5)偏釩酸銨本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因發生氧化還原反應而溶解,同時生成絡合物(NH4)2[(VO)2(C2O4)3],該反應的化學方程式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在某密閉容器中發生反應2HI(g)![]() H2(g)+I2(g) ΔH>0,若在0~15s內c(HI)由0.1mol·L-1降到0.07mol·L-1,則下列說法正確的是
H2(g)+I2(g) ΔH>0,若在0~15s內c(HI)由0.1mol·L-1降到0.07mol·L-1,則下列說法正確的是
A. 升高溫度正反應速率加快,逆反應速率減慢
B. 減小反應體系的體積,化學反應速率加快
C. c(HI)由0.07mol·L-1降到0.05mol·L-1所需的反應時間小于10s
D. 0~15s內用I2表示的平均反應速率為v(I2)=0.002mol·L-1·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】藥用有機化合物A(C8H8O2)為一種無色液體。從A出發可發生如圖所示的一系列反應。則下列說法正確的是
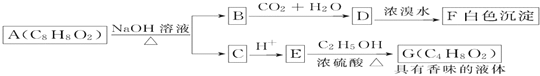
A. 根據D和濃溴水反應生成白色沉淀可推知D為三溴苯酚
B. 上述各物質中能發生水解反應的有A、B、D、G
C. G的同分異構體中屬于酯且能發生銀鏡反應的有2種
D. 1molA能與lmolNaOH反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式表達正確的是
A.用惰性電極電解熔融氯化鈉:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用氫氧化鈉溶液除去鋁表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O
C.澄清的石灰水與稀鹽酸反應Ca(OH)2+2H+=Ca2++2H2O
D.用食醋除去水瓶中的水垢(CaCO3):CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
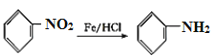
【題目】有機合成是制藥工業中的重要手段。G是某抗炎癥藥物的中間體,其合成路線如圖:
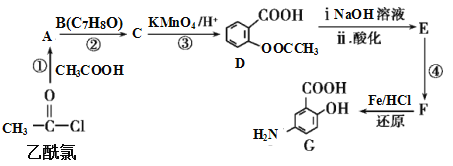
已知:
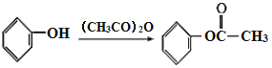 ,
,
(1)B的結構簡式為_____。
(2)反應④的條件為____;①的反應類型為___;反應②的作用是____。
(3)下列對有機物G的性質推測正確的是____(填選項字母)。
A.具有兩性,既能與酸反應也能與堿反應
B.能發生消去反應、取代反應和氧化反應
C.能聚合成高分子化合物
D.1mol G與足量NaHCO3溶液反應放出2mol CO2
(4)D與足量的NaOH溶液反應的化學方程式為_____。
(5)符合下列條件的C的同分異構體有___種。
A.屬于芳香族化合物,且含有兩個甲基 B.能發生銀鏡反應 C.與FeCl3溶液發生顯色反應
其中核磁共振氫譜有4組峰,且峰面積之比為6∶2∶1∶1的是___(寫出其中一種的結構簡式)。
(6)已知:苯環上有烷烴基時,新引入的取代基連在苯環的鄰、對位;苯環上有羧基時,新引入的取代基連在苯環的間位。根據題中的信息,寫出以甲苯為原料合成有機物![]() 的流程圖(無機試劑任選)。_______
的流程圖(無機試劑任選)。_______
合成路線流程圖示例如圖:X![]() Y
Y![]() Z…目標產物
Z…目標產物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ、含苯酚的工業廢水的處理流程如圖所示。
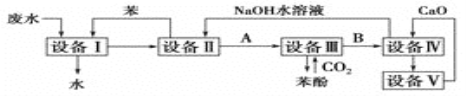
(1)①流程圖設備Ⅰ中進行的是____操作(填寫操作名稱)。實驗室里這一步操作可以用_______(填儀器名稱)進行。
②向設備Ⅱ加入NaOH溶液目的是________(填化學方程式),由設備Ⅱ進入設備Ⅲ的物質A是________(填化學式),由設備Ⅲ進入設備Ⅳ的物質B是________。
③在設備Ⅲ中發生反應的化學方程式為___________________________________。
④在設備Ⅳ中,CaO與水反應后的產物與B的水溶液反應的化學方程式為_____________。通過________(填操作名稱)操作,可以使產物相互分離。
⑤圖中,能循環使用的物質是________、________、________、和________。
(2)為了防止水源污染,用簡單而又現象明顯的方法檢驗某工廠排放的污水中有無苯酚,此方法是_______。
(3)從溶有乙醇的苯酚溶液中回收苯酚有下列操作①蒸餾②過濾③靜置分液④加入足量的金屬鈉⑤通入過量的CO2氣體⑥加入足量的NaOH溶液⑦加入足量的FeCl3溶液 ⑧加入硫酸與NaBr共熱,合理的步驟是___________
Ⅱ.某化學興趣小組的同學在乙醛溶液中加入溴水,溴水褪色。分析乙醛的結構和性質,同學們認為溴水褪色的原因有三種可能(請補充完整):
①溴在不飽和鍵上發生加成反應。
②溴與甲基上的氫原子發生取代反應。
③______________________。
為確定此反應的機理,同學們進行了如下探究:
(1)向反應后的溶液中加入硝酸銀溶液,若有沉淀產生,則上述第________種可能被排除。
(2)有同學提出通過檢測反應后溶液的酸堿性作進一步驗證,就可確定該反應究竟是何種反應原理。此方案是否可行?________,理由是__________________________。
(3)若反應物Br2與生成物Br-的物質的量之比是1∶2,則乙醛與溴水反應的化學方程式為________________________。
(4)已知烯烴能發生如下反應: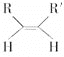
![]() RCHO+R′CHO請寫出下列反應產物的結構簡式:
RCHO+R′CHO請寫出下列反應產物的結構簡式:
![]() ___________________________________________;
___________________________________________;
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com