
【題目】某化學實驗小組利用實驗室中的一瓶未知白色固體粉末進行了如下實驗:
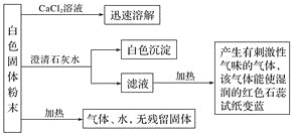
請回答下列問題:
(1)白色沉淀為______________________(填化學式,下同),產生的有刺激性氣味的氣體是_____________________。
(2)該白色固體粉末是___________________(填化學式)。
(3)寫出該白色固體粉末受熱分解的化學方程式:_______________________________
【答案】CaCO3 NH3 NH4HCO3 NH4HCO3 ![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
【解析】
該白色固體加入CaCl2溶液,迅速溶解,溶液中無CO32-,加入澄清石灰水中有白色沉淀生成,說明白色固體中含有HCO3-,加熱加入澄清石灰水后所得濾液,有刺激性氣味的氣體產生,且該氣體能使濕潤的紅色石蕊試紙變藍,說明白色固體粉末中有NH4+,故該白色固體是NH4HCO3。
(1)白色固體粉末加入CaCl2溶液,迅速溶解,溶液中無有CO32-,加入澄清石灰水中有白色沉淀生成,說明白色固體中含有HCO3-,白色沉淀為CaCO3,加熱加入澄清石灰水后所得濾液,有刺激性氣味的氣體產生,且該氣體能使濕潤的紅色石蕊試紙變藍,故該氣體是NH3;
(2)有白色固體中含有NH4+、HCO3-,故該白色固體粉末是NH4HCO3;
(3)該白色固體粉末受熱分解即NH4HCO3受熱分解,化學方程式為:NH4HCO3 ![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】燃料電池作為安全性能較好的一類化學電源得到了更快的發展,一種以聯氨(N2H4)為燃料的環保電池工作原理如圖所示,工作時產生穩定無污染的物質。下列說法正確的是
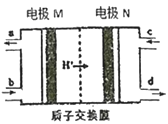
A. M極生成氮氣且電極附近pH降低
B. 負極上每消耗1 mol N2H4,會有2 molH+通過質子交換膜
C. 正極的電極反應式為:O2+2H2O+4e-=4OH-
D. 電極M是原電池的正極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在反應3BrF3+5H2O===HBrO3+Br2+9HF+O2↑中,若有5 mol H2O作為還原劑時,被還原的BrF3的物質的量為( )
A. 3 mol B. 2 mol C. ![]() mol D.
mol D. ![]() mol
mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某反應中的反應物和生成物有 FeCl3、FeCl2、Cu、CuCl2。有人將上述反應設計成原電池并畫圖。
(1)該電池總反應的離子方程式為_____;
(2)畫出原電池裝置圖_____;
(3)一段時間后負極質量減輕 m g,則下列說法正確的是_____(填寫序 號)。(Cu:64、Fe:56)
A.電路中通過的電子為 ![]() mol
mol
B.正極質量增加 ![]() g
g
C.原電池工作過程中電子由正極經導線流向負極
D.原電池工作過程中 Cl-向負極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學實驗小組用酸性 KMnO4 溶液和草酸(H2C2O4)溶液反應,研究外界條件對反應速率的影響,實驗操作及現象如下:
編號 | 實驗操作 | 實驗現象 |
I | 向一支試管中先加入 1 mL 0.01 mol/L 酸 性 KMnO4 溶液,再加入 1 滴 3 mol/L 硫酸和 9 滴蒸餾水,最后加入 1 mL 0.1 mol/L草酸溶液 | 前 10 min 內溶液紫色無明顯變化,后顏色逐漸變淺, 30 min 后幾乎變為無色 |
II | 向另一支試管中先加入 1 mL 0.01 mol/L 酸性 KMnO4 溶液,再加入 10 滴 3 mol/L硫酸,最后加入 1 mL 0.1 mol/L 草酸溶液 | 80 s 內溶液紫色無明顯變 化,后顏色迅速變淺,約 150 s 后幾乎變為無色 |
(1)補全高錳酸鉀與草酸反應的離子方程式:5H2C2O4 + 2MnO4- + 6H+ =2Mn2+ +_____+_____
(2)由實驗 I、II 可得出的結論是_____。
(3)該小組同學根據經驗繪制了n(Mn2+)隨時間變化趨勢的示意圖,如圖1所示。但有同學查閱已有的實驗資料發現,該實驗過程中n(Mn2+) 隨時間變化的趨勢應如圖2所示。
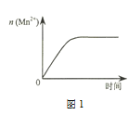
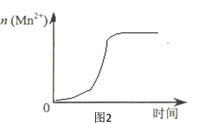
該小組同學根據圖2所示信息關于實驗II中80 s后溶液顏色迅速變淺的原因,該小組提出了猜想提出了新的猜想,并繼續進行實驗探究。
Ⅰ.該小組同學提出的猜想是_____。
Ⅱ.請你幫助該小組同學完成實驗方案,并填寫表中空白。
(實驗內容及記錄)(H2C2O4 溶液足量)
實驗編號 | 室溫下,試管中所加試劑及其用量 / mL | 再向試管中加入少量固體 | 室溫下溶液顏色褪至無色所需時間 / min | ||
0.1 mol/L H2C2O4 溶液 | 0.01 mol/L KMnO4 溶液 | 3 mol/L 稀硫酸 | |||
1 | 1.0 | 1.0 | 10 滴 | 無 | 150S |
2 | 1.0 | 1.0 | 10 滴 | _____ | t |
Ⅲ.若該小組同學提出的猜想成立,則 t______“>”“<”“=”) 150S應觀察到的現象是_____。
(4)該小組擬采用如圖所示的實驗方案繼續探究外界條件對反應速率的影響。
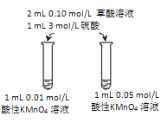
① 他們擬研究的影響因素是_____。
② 你認為他們的實驗方案_____(填“合理”或“不合理”),理由是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用石灰乳和硝酸工業的尾氣(含NO、NO2)反應,既能凈化尾氣,又能獲得應用廣泛的Ca(NO2)2,其部分工藝流程如下:
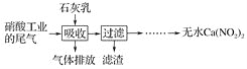
(1)一定條件下,NO與NO2可以生成一種新的氧化物,試寫出該反應的化學方程式:___。
(2)上述工藝中采用氣液逆流接觸吸收(尾氣從吸收塔底部進入,石灰乳從吸收塔頂部噴淋),其目的是__;濾渣可循環使用,濾渣的主要成分是__(填化學式)。
(3)該工藝需控制NO和NO2物質的量之比接近1∶1。
若n(NO)∶n(NO2)>1∶1,則會導致__;
若n(NO)∶n(NO2)<1∶1,則會導致__。
(4)生產中溶液需保持弱堿性,在酸性溶液中Ca(NO2)2會發生分解,產物之一是NO,其反應的離子方程式為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸的工業制備是一個重要的化工生產過程,但在生產過程中會產生大量污染,需要在生產工藝中考慮到綠色工藝.以硫酸工業產生的二氧化硫尾氣、氨水、石灰石、焦炭、碳酸氫銨為原料可以合成硫化鈣、硫酸銨、亞硫酸銨等物質.合成路線如下:
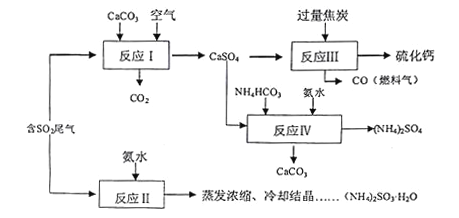
(1)寫出反應Ⅰ的化學方程式________________________.
(2)反應Ⅲ中每生成lmol硫化鈣理論上轉移電子數________;為充分利用副產品CO,有人提出以熔融的K2C03為電解質,設計燃料電池,請寫出此電池的負極反應_____________.
(3)為檢驗反應Ⅱ得到的產品是否因部分被氧化而變質,需選擇的化學試劑有__________________.
(4)根據合成流程,可以循環利用的是____________.
(5)(NH4)2SO3溶液可用于電廠產生的煙道氣的脫氮,將氮氧化物轉化為氮氣,同時生成一種氮肥,形成共生系統.寫出二氧化氮與亞硫酸銨反應的離子方程式___________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關熱化學反應的描述正確的是( )
A.HCl和NaOH反應的中和熱ΔH=-57.3kJ/mol,則H2SO4和Ca(OH)2反應的中和熱ΔH=2×(-57.3)kJ/mol
B.CO的燃燒熱ΔH=-283.0kJ/mol,則2CO2(g)=2CO(g)+O2(g) ΔH=(2×283.0)kJ/mol
C.已知:C(s)+O2(g)=CO2(g)△H1;C(s)+![]() O2(g)=CO(g)△H2 ,則△H1>△H2
O2(g)=CO(g)△H2 ,則△H1>△H2
D.C(石墨,s)= C(金剛石,s) ΔH=+1.9kJ·mol-1 ,則金剛石比石墨穩定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據雜化軌道理論和價電子對互斥理論模型判斷,下列分子或離子的中心原子雜化方式及空間構型正確的是( )
選項 | 分子或離子 | 中心原子雜化方式 | 價電子對互斥理論模型 | 分子或離子的空間構型 |
A | H2O | sp | 直線形 | 直線形 |
B | BBr3 | sp2 | 平面三角形 | 三角錐形 |
C | PCl3 | sp2 | 四面體形 | 平面三角形 |
D | CO32- | sp2 | 平面三角形 | 平面三角形 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com