
【題目】有機物A可由葡萄糖發酵得到,也可從酸牛奶中提取.純凈的A為無色粘稠液體,易溶于水。為研究A的組成與結構,進行了如下實驗:
(1)稱取A9.0g,升溫使其汽化,測其密度是相同條件下H2的45倍。則A的相對分子質量為:___。
(2)將此9.0gA在足量純O2充分燃燒,并使其產物依次緩緩通過濃硫酸、堿石灰,發現兩者分別增重5.4g和13.2g。則A的分子式為:___。
(3)另取A9.0g,跟足量的NaHCO3粉末反應,生成2.24LCO2(標準狀況),若與足量金屬鈉反應則生成2.24LH2(標準狀況)。用結構簡式表示A中含有的官能團為:___、__。
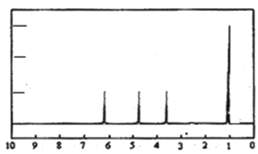
(4)A的核磁共振氫譜如圖:則A中含有___種氫原子。
(5)綜上所述,A的結構簡式為___,跟NaHCO3溶液反應的離子方程式為___。
【答案】90 C3H6O3 —COOH —OH 4  CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑
CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑
【解析】
(1)有機物質的密度是相同條件下H2的45倍,所以有機物質的分子式量為:45×2=90;
(2)9.0g物質A的物質的量為0.1mol;濃硫酸增重5.4g,則生成水的質量是5.4g,生成水的物質的量為:![]() =0.3mol,所含有氫原子的物質的量是0.6mol,堿石灰增重13.2g,所以生成二氧化碳的質量是13.2g,所以生成二氧化碳的物質的量是:
=0.3mol,所含有氫原子的物質的量是0.6mol,堿石灰增重13.2g,所以生成二氧化碳的質量是13.2g,所以生成二氧化碳的物質的量是:![]() =0.3mol,所以碳原子的物質的量是0.3mol,所以有機物中碳個數是3,氫個數是6,根據相對分子質量是90,所以氧原子個數是
=0.3mol,所以碳原子的物質的量是0.3mol,所以有機物中碳個數是3,氫個數是6,根據相對分子質量是90,所以氧原子個數是![]() =3,即分子式為:C3H6O3;
=3,即分子式為:C3H6O3;
(3)只有羧基可以和碳酸氫鈉發生化學反應生成二氧化碳,0.1molA可生成2.24LCO2(標準狀況)即0.1mol二氧化碳,則含有一個-COOH;
醇羥基和羧基可以和金屬鈉發生反應生成氫氣,0.1molA與足量金屬鈉反應生成2.24LH2(標準狀況)即0.1mol氫氣,且已知含有一個羧基,則還含有一個-OH;
(4)根據核磁共振氫譜圖看出有機物中有4個峰值,則含4種環境的氫原子;
(5)綜上所述A的結構簡式為 ;與碳酸氫鈉反應生成二氧化碳和水以及相應的鈉鹽,離子方程式為:CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑。
;與碳酸氫鈉反應生成二氧化碳和水以及相應的鈉鹽,離子方程式為:CH3CHOHCOOH+HCO3-=CH3CHOHCOO-+H2O+CO2↑。


科目:高中化學 來源: 題型:
【題目】Cu3N具有良好的電學和光學性能,在電子工業領域、航空航天領域、國防領域、通訊領域以及光學工業等領域中,發揮著廣泛的、不可替代的巨大作用。
(1)N位于周期表中的位置為_____________,NF3的分子立體構型名稱是____________。類比NH3·H2O表示出代表性分子NH4F含有的氫鍵________________________。
(2)寫出N2O的等電子體__________________(1個分子和1個離子)。
(3)Cu原子的基態外圍電子排布式為____________;已知:CuO在高溫下會分解成Cu2O,試從洪特規則角度解釋其原因__________________________________________________。
(4) 在Cu的催化作用下,乙醇可被空氣氧化為乙醛(CH3CHO),乙醛分子中H—C=O的鍵角______(填“大于”“等于”或“小于”)乙醇分子中的H—C—O的鍵角。
(5) 某化肥廠從生產的硫酸銨中檢出一種組成為N4H4(SO4)2的物質。其水溶液中的N4H44+遇堿生成一種形似白磷的N4分子。畫出N4H44+的結構式(標明其中的配位鍵)__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物X的結構簡式如圖所示,則下列有關說法中正確的是( )
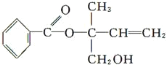
A.X的分子式為C12H16O3
B.X在一定條件下能發生加成、加聚、取代、消去等反應
C.在Ni作催化劑的條件下,1molX最多只能與1molH2加成
D.可用酸性高錳酸鉀溶液區分苯和X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對反應Al2O3+N2+3C ![]() 2AlN+3CO的敘述正確的是
2AlN+3CO的敘述正確的是
A. Al2O3是氧化劑,C是還原劑 B. 每生成1 mol CO需轉移2 mol電子
C. AlN中氮元素的化合價為+3 D. N2發生了氧化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學課外小組用圖裝置制取溴苯。先向分液漏斗中加入苯和液溴,再將混合液慢慢滴入反應器A(A下端活塞關閉)中。

(1)寫出A中反應的化學方程式_______________。
(2)觀察到A中的現象是_____________________。
(3)實驗結束時,打開A下端的活塞,讓反應液流入B中,充分振蕩,目的是________,寫出有關的化學方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能證明苯和液溴發生的是取代反應,而不是加成反應,可向試管D中加入AgNO3溶液,若產生淡黃色沉淀,則能證明。另一種驗證的方法是向試管D中加入_______,現象是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據反應KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)設計如下原電池,其中甲、乙兩燒杯中各物質的物質的量濃度均為1 mol·L-1,溶液的體積均為200 mL,鹽橋中裝有飽和K2SO4溶液。下列說法不正確的是( )
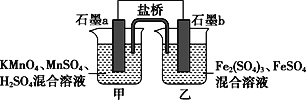
A. 石墨b是原電池的負極,發生氧化反應
B. 甲燒杯中的電極反應式:MnO4-+5e-+8H+===Mn2++4H2O
C. 電池工作時,鹽橋中的陰陽離子分別向乙甲燒杯中移動,保持溶液中的電荷平衡
D. 忽略溶液體積變化,Fe2(SO4)3濃度變為1.5 mol/L,則反應中轉移的電子為0.1 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某有機物A的紅外光譜和核磁共振氫譜如圖所示,下列說法中錯誤的是( )
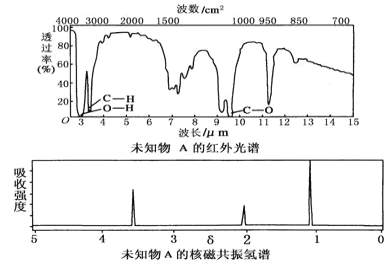
A.由紅外光譜可知,該有機物中至少有三種不同的化學鍵
B.由核磁共振氫譜可知,該有機物分子中有三種不同化學環境的氫原子
C.僅由其核磁共振氫譜無法得知其分子中的氫原子總數
D.若A的化學式為C2H6O,則其結構簡式為CH3—O—CH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇(CH3OH)和二甲醚(CH3OCH3)被稱為21世紀的新型燃料,具有清潔、高效等性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有關反應的熱化學方程式如下:
CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) △H=-49.0 kJ·mol-1
2CH3OH(g)=CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
H2O(l)=H2O(g) △H= + 44 kJ·mol-1
則CO2與H2反應合成二甲醚生成液態水的熱化學方程式為:____________________。
(2)工業上合成甲醇的反應:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能說明該反應在恒溫恒容條件下已達化學平衡狀態的是___________
CH3OH(g) △H=-90.8 kJ·mol-1。 下列不能說明該反應在恒溫恒容條件下已達化學平衡狀態的是___________
A.v正(H2) = 2v逆(CH3OH) B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合氣體的密度不變 D.混合氣體的平均相對分子質量不變 E.容器的壓強不變
(3)若反應2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)在某溫度下的化學平衡常數為400,此溫度下,在密閉容器中加入一定量甲醇,反應進行到某時刻,測得各物質的濃度如下表所示:
CH3OCH3(g) + H2O(g)在某溫度下的化學平衡常數為400,此溫度下,在密閉容器中加入一定量甲醇,反應進行到某時刻,測得各物質的濃度如下表所示:
物質 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
濃度(mol·L-1) | 0.44 | 0.60 | 0.60 |
①比較該時刻正、逆反應速率的大小:v(正)_____v(逆)(填“>”、“<”或“=”)。
②若加入甲醇后,經10 min反應達到平衡,則平衡后c(CH3OH)=______________,
該時間內反應速率v(CH3OCH3)=_____________。
(4)利用二甲醚(CH3OCH3)設計一個燃料電池,用KOH溶液作電解質溶液,石墨做電極,該電池負極電極反應式為___________________________。以此燃料電池作為外接電源按如圖所示電解硫酸銅溶液,如果起始時盛有1000mLpH=5的硫酸銅溶液(25℃,CuSO4足量),一段時間后溶液的pH變為1,若要使溶液恢復到起始濃度(溫度不變,忽略溶液體積的變化),可向溶液中加入______其質量約為_____g。
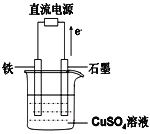
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、Q、W、R的原子序數與其常見化合價關系如圖所示。下列說法正確的是
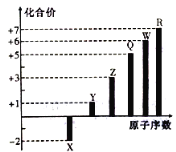
A.X、Y、Z、W、R的簡單離子半徑大小順序為R>W>Z>Y>X
B.Q元素形成的可溶性鹽的溶液不可能顯酸性
C.X、Y、R形成的某種化合物可以用于漂白、消毒
D.Y、Z和W三者最高價氧化物對應的水化物間不能兩兩相互反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com