
【題目】已知 A、B、C、D、E 都是周期表中前四周期的元素,且原子序數依次增大,其中 A 原子核外 有三個未成對電子;A 與 B 可形成離子化合物 B3A2;C 元素是地殼中含量最高的金屬元素;D 原 子核外的 M 層中有兩對成對電子;E 原子核外最外層只有 1 個電子,其余各層電子均充滿。以下 有關說法正確的是
A.A 離子半徑小于 B 離子半徑
B.B 和 C 的氯化物晶體類型相同
C.C 和 D 形成的二元化合物不能通過復分解反應得到
D.E 在周期表中位于第四周期 s 區
【答案】D
【解析】
已知 ![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是周期表中前四周期的元素,且原子序數依次增大,其中
都是周期表中前四周期的元素,且原子序數依次增大,其中 ![]() 原子核外有三個未成對電子,則
原子核外有三個未成對電子,則 ![]() 原子的核外電子排布式為
原子的核外電子排布式為 ![]() ,
,![]() 為
為 ![]() 元素,
元素,![]() 與
與 ![]() 可形成離子化合物
可形成離子化合物 ![]() ,說明
,說明 ![]() 形成離子為
形成離子為 ![]() ,
,![]() 為
為 ![]() 元素,
元素,![]() 元素是地殼中含量最高的金屬元素,則
元素是地殼中含量最高的金屬元素,則 ![]() 為
為 ![]() 元素,
元素,![]() 原子核外最外層只有
原子核外最外層只有 ![]() 個電子,則
個電子,則 ![]() 為
為 ![]() 元素,
元素,![]() 原子核外的
原子核外的 ![]() 層中有兩對成對電子,則
層中有兩對成對電子,則 ![]() 的價電子排布為
的價電子排布為 ![]() ,
,![]() 為
為 ![]() 元素。
元素。
A.![]() 離子為
離子為 ![]() ,
,![]() 離子為
離子為 ![]() ,兩者核外電子排布相同,當電子層數相同時,核電荷數越小,離子半徑越大,所以
,兩者核外電子排布相同,當電子層數相同時,核電荷數越小,離子半徑越大,所以 ![]() 離子半徑大于
離子半徑大于 ![]() 離子半徑,故A錯誤;
離子半徑,故A錯誤;
B.![]() 為離子化合物,
為離子化合物,![]() 為分子化合物,晶體類型不相同,故B錯誤;
為分子化合物,晶體類型不相同,故B錯誤;
C.![]() 的二元化合物
的二元化合物 ![]() 可以由
可以由 ![]() 與
與 ![]() 經過復分解反應得到,故C錯誤;
經過復分解反應得到,故C錯誤;
D.![]() 原子核外最外層只有
原子核外最外層只有 ![]() 個電子,則
個電子,則 ![]() 為
為 ![]() 元素,位于第四周期
元素,位于第四周期 ![]() 區,故D正確;
區,故D正確;
故選D。


 互動英語系列答案
互動英語系列答案科目:高中化學 來源: 題型:
【題目】已知![]() 、
、![]() 均為短周期元素,A元素的陽離子與B元素的陰離子具有相同的電子層結構,有關兩元素有以下敘述:①原子序數:A>B;②原子半徑:A<B;③離子半徑:A>B;④原子最外層電子數:A≤B,其中正確的是( )
均為短周期元素,A元素的陽離子與B元素的陰離子具有相同的電子層結構,有關兩元素有以下敘述:①原子序數:A>B;②原子半徑:A<B;③離子半徑:A>B;④原子最外層電子數:A≤B,其中正確的是( )
A.①②B.①④C.②③D.②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應aA(g)+bB(g)cC(g) ΔH<0在等容條件下進行。改變其它反應條件,在I、II、III階段體系中各物質濃度隨時間變化的曲線如圖所示,下列說法不正確的是
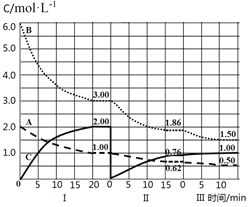
A.反應的化學方程式中,a:b:c=1:3:2
B.第II階段反應溫度小于第III階段反應溫度
C.A的平均反應速率vⅠ(A)、vⅡ(A)、vⅢ(A),最大的是vⅠ(A)
D.由第一次平衡到第二次平衡,采取的措施是從反應體系中移走C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積可變的密閉容器中存在如下反應:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列分析中不正確的是( )
CO2(g)+H2(g) ΔH<0,下列分析中不正確的是( )

A. 圖Ⅰ研究的是t0時升高溫度對反應速率的影響
B. 圖Ⅱ研究的是t0時增大壓強(縮小容積)或使用催化劑對反應速率的影響
C. 圖Ⅲ研究的是催化劑對化學平衡的影響,且甲使用了催化劑
D. 圖Ⅲ研究的是溫度對化學平衡的影響,且乙的溫度較高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列對分子的性質的解釋中,不正確的是
A.CH≡C-CH=CH-CH3 中σ鍵和π鍵數目之比為 10:3
B.![]() 分子中不含手性碳原子
分子中不含手性碳原子
C.硫難溶于水,微溶于酒精,易溶于 CS2,說明極性:水>酒精>CS2
D.由 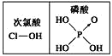 知酸性:H3PO4>HClO
知酸性:H3PO4>HClO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】白磷與氧可發生如下反應:P4+5O2=P4O10。已知斷裂下列化學鍵需要吸收的能量分別為:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根據圖示的分子結構和有關數據估算該反應的△H,其中正確的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在t℃時,將agNH3完全溶于水,得到VmL溶液,設該溶液的密度為ρgcm-3,質量分數為ω,其中含NH4+的物質的量為bmol。下列敘述中不正確的是( )
A.溶質的質量分數為ω=![]() ×100%
×100%
B.溶質的物質的量濃度c=![]() molL-1
molL-1
C.溶液中c(OH-)=![]() mol/L
mol/L
D.上述溶液中再加入VmL水后,所得溶液中溶質的質量分數小于0.5ω
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】8.34 g FeSO4·7H2O(相對分子質量:278)樣品受熱脫水過程的熱重曲線(樣品質量隨溫度變化的曲線)如下圖所示,下列說法正確的是
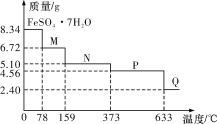
A.溫度為78 ℃時固體物質M的化學式為FeSO4·5H2O
B.溫度為159 ℃時固體N的化學式為FeSO4·2H2O
C.取適量380 ℃時所得的樣品P,隔絕空氣加熱至650 ℃,得到一種固體物質Q,同時只得到一種無色氣體生成
D.在隔絕空氣條件下,N得到P的化學方程式為FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CuCl為白色粉末,微溶于水,不溶于乙醇,潮濕的CuCl在空氣中被氧化為Cu2(OH)3Cl。
(1)一種由海綿銅(Cu)為原料制備CuCl的工藝流程如下:

①“溶解”步驟發生反應的離子方程式為_________________________________;
②潮濕的CuCl在空氣中被氧化的化學反應方程式為_________________________________;
③已知常溫下Cu(OH)2溶度積常數Ksp=2×10-20要使c(Cu2+)=0.2 mol·L-1的硫酸銅溶液中的銅離子沉淀比較完全(使銅離子濃度變為原來的千分之一)則應調節溶液pH為___________以上。
(2)次磷酸(H3PO2)是一元中強酸,可用于作金屬表面處理劑。
①向Ba(H2PO2)2溶液中加入硫酸可以制取H3PO2,寫出反應的化學方程式:_____________;
②H3PO2可將溶液中的Ag+還原為銀,從而用于化學鍍銀,反應同時生成P元素最高價氧化物對應的水化物。在該過程中,氧化劑與還原劑的物質的量之比為:___________;
③NaH2PO2的水溶液呈弱堿性,用離子方程式說明原因:______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com