先分析MgSO4與其余五種化合物反應時應觀察到的現象:
MgSO4+BaCl2=MgCl2+BaSO4↓ 有沉淀生成
MgSO4+(NH4)2CO3=(NH4)2SO4+MgCO3↓ 有沉淀生成
MgSO4+2AgNO3=Ag2SO4↓+Mg(NO3)2 有沉淀生成
MgSO4+HBr
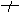
無明顯變化
MgSO4+ 2NaOH=Mg(OH)2↓+Na2SO4 有沉淀生成
結果表明MgSO4與其他五種化合物的溶液反應時,應有四種發生沉淀,另一種無明顯變化,這與表中C的</PGN0083B.TXT/PGN>情況完全一樣,而不同于其他任何一種,故可判定C為MgSO4。再分析BaCl2與其余五種化合物溶液反應時應觀察到的現象:
BaCl2+MgSO4=BaSO4↓+MgCl2 有沉淀生成
BaCl2+(NH4)2CO3=BaCO3↓+2NH4Cl 有沉淀生成
BaCl2+2AgNO3=2AgCl↓+ Ba(NO3)2 有沉淀生成
BaCl2+2HBr
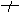
無明顯變化
BaCl2+2NaOH
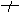
無明顯變化
結果是有三種生成沉淀,兩種無變化,和D與其他五種溶液反應所得的現象一致,而與其他均不同,故D為BaCl2。
用類似的方法可以判定A為(NH4)2CO3,F為AgNO3,E為HBr,B為NaOH。

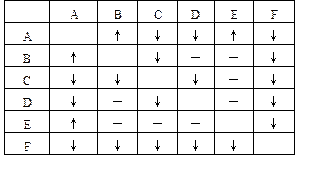
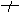 無明顯變化
無明顯變化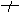 無明顯變化
無明顯變化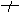 無明顯變化
無明顯變化

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案