
【題目】某溫度時,反應X(g)![]() 4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密閉容器中進行,X和Z的濃度隨時間變化如圖所示,下列說法正確的是
4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密閉容器中進行,X和Z的濃度隨時間變化如圖所示,下列說法正確的是
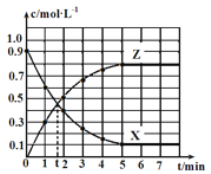
A.2 min內,X的平均反應速率為0.5 mol·L-1·min-1
B.5 min內,反應放出的熱量為0.8Q kJ
C.第5 min后,X的生成速率與Y的生成速率相等且保持不變
D.第t min時,該反應未達到平衡狀態
【答案】D
【解析】
由圖可以知道,X的濃度從開始到5min時一直在減少,第5min時,濃度不再發生變化,則該反應達到平衡狀態,
A.結合 計算;
計算;
B.物質的量與反應中熱量變化成正比.
C.平衡時,不同物質的正逆反應速率之比等于化學計量數之比;
D.平衡時各物質的濃度不變;
A.由圖可以知道,2min內,X的濃度變化量為0.9mol/L-0.4mol/L=0.5mol/L,則X的平均反應速率為0.5mol/L÷2min=0.25mol/(L·min),A項錯誤;
B.5min內參加反應的X為2L×(0.9mol/L-0.1mol/L)=1.6mol,結合熱化學方程式可以知道1molX反應放熱為QkJ,則反應放出的熱量為1.6QkJ,B項錯誤;
C.第5min后,為平衡狀態,Y與X的化學計量數之比為4:1,則Y的生成速率的4倍與X的生成速率相等且保持不變,C項錯誤;
D.第5min時,X的物質的量濃度不再變化,該反應達到平衡狀態,tmin時X的物質的量濃度仍在變化,該反應未達到平衡狀態,D項正確;
答案選D。


科目:高中化學 來源: 題型:
【題目】在4 L密閉容器中充入6 mol A氣體和5 mol B氣體,在一定條件下發生反應:3A(g)+B(g)![]() 2C(g)+xD(g),5 s達到平衡。達到平衡時,生成了2 mol C,經測定D的濃度為0.5 mol·L-1,下列判斷正確的是( )
2C(g)+xD(g),5 s達到平衡。達到平衡時,生成了2 mol C,經測定D的濃度為0.5 mol·L-1,下列判斷正確的是( )
A. x=1B. B的轉化率為20%
C. 平衡時A的濃度為1.50 mol·L-1D. B的平均反應速率為0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氯化六氨合鈷[Co(NH3)6]Cl3是橙黃色的配合物,是合成其它一些含鈷配合物的原料。利用含鈷廢料(含少量Fe、Al等雜質)制取[Co(NH3)6]Cl3的工藝流程如圖,回答下列問題:
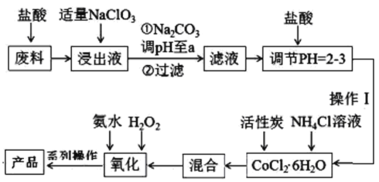
已知:①“浸出液”中含有Co2+、Fe2+、Fe3+、Al3+等
②Ksp[Co(OH)2]=6×10-15、Ksp[Co(OH)3]=1.6×10-44
(1)加“適量NaClO3”的作用是___,發生反應的離子方程式為___。
(2)“加Na2CO3調pH至a”會生成兩種沉淀,分別為___(填化學式)。
(3)操作Ⅰ的步驟包括___、___、減壓過濾。
(4)流程中“氧化”過程應先加入___(填“氨水”或“H2O2”),需水浴控溫在50~60℃,溫度不能過高,原因是___。寫出“氧化”步驟發生反應的離子方程式:___,若無活性炭作催化劑,所得固體產物中除[Co(NH3)6]Cl3外還會有大量二氯化一氯五氨合鈷[Co(NH3)5Cl]Cl2和三氯化五氨一水合鈷[Co(NH3)5H2O]Cl3晶體,這體現了催化劑的___性。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上除去電石渣漿(含CaO)上清液中的S2-,并制取石膏(CaSO42H2O)的常用流程如圖:
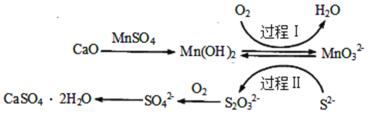
下列說法不正確的是( )
A.過程Ⅰ、Ⅱ中起催化劑作用的物質是Mn(OH)2
B.常溫下,56gCaO溶于水配成1L溶液,溶液中Ca2+的數目為6.02×1023個
C.將10L上清液中的S2-轉化為SO![]() (S2-濃度為320mg·L-1),理論上共需要0.2mol的O2
(S2-濃度為320mg·L-1),理論上共需要0.2mol的O2
D.過程Ⅱ中,反應的離子方程式為4MnO![]() +2S2-+9H2O=S2O
+2S2-+9H2O=S2O![]() +4Mn(OH)2↓+10OH-
+4Mn(OH)2↓+10OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按照下圖所示的操作步驟,完成Ba(OH)2·8H2O與氯化銨晶體反應的實驗。
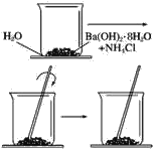
回答下列問題
(1)實驗過程中觀察到的現象是________________________。
(2)寫出該反應的化學方程式___________________。
(3)該反應是放熱反應還是吸熱反應________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化碳的捕集與利用是實現溫室氣體減排的重要途徑之一。
(1)目前工業上使用的捕碳劑有 NH3 和(NH4)2CO3,它們與 CO2 可發生如下可逆反應:
2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) K1
(NH4)2CO3(aq) K1
NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) K2
NH4HCO3(aq) K2
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) K3
2NH4HCO3(aq) K3
則 K3=________(用含 K1、K2 的代數式表示)。
(2)利用 CO2 制備乙烯是我國能源領域的一個重要戰略方向,具體如下:
方法一:
CO2 催化加氫合成乙烯,其反應為:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H=a kJ·mol-1起始時按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密閉容器中,不同溫度下平衡時H2和H2O的物質的量如圖甲所示:
C2H4(g)+4H2O(g) △H=a kJ·mol-1起始時按 n(CO2)∶n(H2)=1∶3的投料比充入20 L的恒容密閉容器中,不同溫度下平衡時H2和H2O的物質的量如圖甲所示:

①a______0(選填“>”或“<”)。
②下列說法正確的是______(填字母序號)。
A 、使用催化劑,可降低反應活化能,加快反應速率
B 、其它條件不變時,若擴大容器容積,則 v正減小,v逆增大
C 、測得容器內混合氣體密度不隨時間改變時,說明反應已達平衡
③393 K下,H2的平衡轉化率為________(保留三位有效數字)。
④393 K下,該反應達到平衡后,再向容器中按 n(CO2)∶n(H2)=1∶3 投入 CO2 和 H2 ,則n(H2)/n(C2H4)將____(填“變大”、“不變”或“變小”)。
方法二:
用惰性電極電解強酸性的二氧化碳水溶液可得到乙烯,其原理如圖乙所示。
⑤b電極上的電極反應式為_______。
⑥該裝置中使用的是__________(填“陰”或“陽”)離子交換膜。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧化鈰Ce(OH)4是一種重要的稀土氫氧化物,它可由氟碳酸鈰礦(主要含CeFCO3)經如下流程獲得:
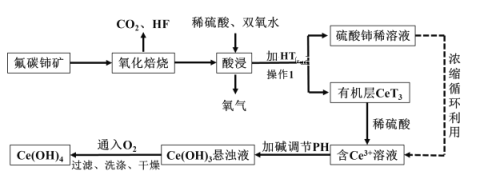
已知:在酸性溶液中![]() 有強氧化性,回答下列問題:
有強氧化性,回答下列問題:
(1)氧化培燒時不能使用陶瓷容器,原因是_____________________________________。
(2)氧化焙燒生成的鈰化合物二氧化鈰(CeO2),其在酸浸時反應的離子方程式為___________;
(3)已知有機物HT能將![]() 從水溶液中萃取出來,該過程可表示為:
從水溶液中萃取出來,該過程可表示為:![]() (水層)+
(水層)+![]() (有機層)
(有機層)![]()
![]() +
+![]() (水層)從平衡角度解釋:向
(水層)從平衡角度解釋:向![]() (有機層)加入
(有機層)加入![]() 獲得較純的含
獲得較純的含![]() 的水溶液的原因是________________;
的水溶液的原因是________________;
(4)取某Ce(OH)4產品0.50g,加硫酸溶解后,與23.00mL0.1000mol/L的FeSO4溶液恰好完全反應(鈰被還原成Ce3+).(已知:Ce(OH)4的相對分子質量為208)
①FeSO4在該反應中作________劑(填“氧化”或“還原”);
②計算Ce(OH)4產品的純度____________;
③若用硫酸酸化后改用0.1000mol/L的FeCl2溶液滴定產品從而測定Ce(OH)4產品的純度,其它操作都正確,則測定的Ce(OH)4產品的純度____________(填“偏高”、“偏低”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煙氣脫硫能有效減少二氧化硫的排放。實驗室用粉煤灰(主要含Al2O3、SiO2等)制備堿式硫酸鋁[Al2(SO4)3·Al2O3]溶液,并用于煙氣脫硫研究。
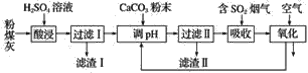
(1)酸浸時反應的化學方程式為_______________________________________________;濾渣Ⅰ的主要成分為________(填化學式)。
(2)濾渣Ⅱ的主要成分為________(填化學式);制備堿式硫酸鋁[Al2(SO4)3·Al2O3]溶液的化學方程式為_________________________________________________________________。
(3)吸收煙氣中SO2的化學方程式為Al2(SO4)3·Al2O3+3SO2=Al2(SO4)3·Al2(SO3)3。通入空氣氧化,發生反應的化學方程式為_______________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知pOH=-lg c(OH-),向20 mL 0.1 mol·L-1的氨水中滴加未知濃度的稀硫酸,測得混合溶液的溫度、pOH隨加入稀硫酸體積的變化如下圖所示,下列說法正確的是
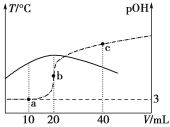
A.稀硫酸的物質的量濃度為0.1 mol·L-1
B.當溶液中pH=pOH時,水的電離程度最大
C.a點時溶液中存在c(NH3·H2O)+2c(OH-)=c(NH4+)+2c(H+)
D.a、b、c三點對應NH4+的水解平衡常數:Kh(c)>Kh(b)>Kh(a)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com