(10分)工業上利用含錳廢水(主要含MnSO
4、H
2SO
4、和鐵、鋁、銅等金屬的硫酸鹽)制取碳酸錳(MnCO
3)。步驟如下:
Ⅰ.氧化:向廢水中加入氧化劑;
Ⅱ.中和:控制溫度在40~50 ℃,加入氨水,過濾;
Ⅲ.除重金屬:向濾液中加入BaS溶液,除去Cu
2+等重金屬,過濾,得MnSO
4溶液;
Ⅳ.制固體MnSO
4:從MnSO
4溶液得其固體;
Ⅴ.制MnCO
3:用水溶解MnSO
4固體,加入NH
4HCO
3溶液,得MnCO
3沉淀粗品;
Ⅵ.洗滌:用水洗滌MnCO
3粗品至無SO
42-,獲得高純MnCO
3。
回答下列問題:
(1)Ⅰ中,下列氧化劑均能把Fe
2+氧化為Fe
3+,最佳的試劑是_____。
a.濃HNO
3 b.MnO
2 c.K
2Cr
2O
7 (2)Ⅱ中,氨水除中和酸外,同時沉淀Fe
3+、Al
3+等,沉淀Al
3+的離子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需濃縮、結晶、_______(填一種分離操作的名稱),得MnSO
4固體。
(4)Ⅴ中生成MnCO
3沉淀的離子方程式是:
______________________________________________________。
(5)由MnCO
3可制得重要的催化劑MnO
2,MnCO
3 → MnO
2 + CO。
現加熱分解 460.0 kg的MnCO
3,得到332.0 kg產品,若產品中雜質只有MnO,則該產品中MnO
2的質量是
kg。(摩爾質量/g·
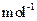
:MnCO
3 115 MnO
2 87 MnO 71)
