
【題目】下列有關油脂的敘述不正確的是( )
A.天然油脂是混合物,沒有固定的熔點和沸點
B.油脂是酯的一種
C.油脂是由高級脂肪酸和甘油所生成的酯
D.油脂都不能使溴水褪色
科目:高中化學 來源: 題型:
【題目】室溫下,將0.05molNa2CO3固體溶于水配成100mL溶液,向溶液中加入下列物質,有關結論正確的是
選項 | 加入的物質 | 結論 |
A | 50mL 1mol·L﹣1H2SO4 | 反應結束后,c(Na+)=c(SO42﹣) |
B | 0.05mol CaO | 溶液中 |
C | 50mL H2O | 由水電離出的c(H+)·c(OH﹣)不變 |
D | 0.1mol NaHSO4固體 | 反應完全后,溶液pH減小,c(Na+)不變 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室里需要純凈的NaCl溶液,但手邊只有混有Na2SO4、NaHCO3的NaCl。某學生設計了如圖所示方案提取純凈的NaCl溶液。

如果此方案正確,那么:
(1)操作④為________,操作①、④、⑤都用到的玻璃儀器有____________。
(2)操作②為什么不用硝酸鋇溶液,其理由是___________________________________。
(3)進行操作②后,如何判斷SO42-已除盡,方法是_______________________________。
(4)操作③的目的是____________,為什么不先過濾后加碳酸鈉溶液?理由是____________。
(5)操作⑤的目的是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從海水提取鎂和溴的流程如下,請回答相關問題。

(1)海水進入沉淀池前,對海水進行處理有以下兩種方案:
方案一:將曬鹽后的鹵水通入沉淀池;
方案二:將加熱蒸發濃縮后的海水通入沉淀池。
你認為方案_________更合理。操作1的名稱_________。
(2)提取鎂和溴
①試劑a為_________(填化學式),通入試劑a發生反應的離子方程式_________。
②吹出塔中通入熱空氣的目的是_________。
③吸收塔中發生反應離子方程式是_________。
④無水MgCl2制備Mg的化學方程式是_____。
(3)提取溴的過程中,經過2次Br-→Br2轉化的目的是__。
(4)從海水中提取溴的工藝也可以按如下圖所示(框圖中是主要產物):

i. 過程③中反應的離子方程式是________。
ii. 若最終得到的溴單質中仍然混有少量的Cl2,應加入_________將其除去。
A. NaI B. NaBr C. SO2 D. NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CoCl2·6H2O是一種飼料營養強化劑。一種利用水鈷礦(主要成分為Co2O3、Co(OH)3,還含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工藝流程如下:
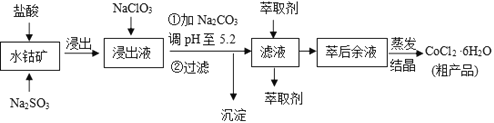
已知:①浸出液含有的陽離子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:(金屬離子濃度為:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔點為86℃,加熱至110~120℃時,失去結晶生成無水氯化鈷。
(1)寫出浸出過程中Co2O3發生反應的離子方程式______________________________。
(2)寫出NaClO3發生反應的主要離子方程式________________;若不慎向“浸出液”中加過量NaClO3時,可能會生成有毒氣體,寫出生成該有毒氣體的離子方程式_________________________________________________。
(3)“加Na2CO3調pH至5.2”,過濾所得到的沉淀成分為____________、_______________________
(4)制得的CoCl2·6H2O在烘干時需減壓烘干的原因是__________________________。
(5)為測定粗產品中CoCl2·6H2O含量,稱取一定質量的粗產品溶于水,加入足量HNO3酸化的AgNO3溶液,過濾、洗滌,將沉淀烘干后稱其質量。通過計算發現粗產品中CoCl2·6H2O的質量分數大于100%,其原因可能是______。(答一條即可)
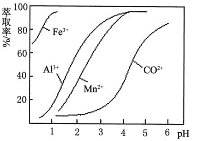
(6)萃取劑對金屬離子的萃取率與pH的關系如圖。萃取劑的作用是___________________;其使用的適宜pH范圍是__________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,1-二環丙基乙烯(![]() )是重要醫藥中間體,下列關于該化合物的說法錯誤的是
)是重要醫藥中間體,下列關于該化合物的說法錯誤的是
A. 所有碳原子不能在同一平面 B. 能被酸性髙錳酸鉀溶液氧化
C. 二氯代物只有3種 D. 生成1 molC8H18至少需要3molH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上消除氮氧化物的污染,可用如下反應:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
在溫度T1和T2時,分別將0.50 mol CH4和1.2 mol NO2充入體積為1 L的密閉容器中,測得n(CH4)隨時間變化數據如下表:
溫度 | 時間/min n/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列說法不正確的是
A. 10 min內,T1時v(CH4)T2時小 B. 溫度:T1<T2
C. ΔH:a < 0 D. 平衡常數:K(T1)<K(T2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下圖裝置測定中和熱的實驗步驟如下:

①用量筒量取50mL 0.25mol/L硫酸倒入小燒杯中,測出硫酸溫度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一溫度計測出其溫度;
③將NaOH溶液倒入小燒杯中,設法使之混合均勻,測出混合液的最高溫度。
回答下列問題:
(1)儀器A的名稱為_________________________。
(2)倒入NaOH溶液的正確操作是________。
A.沿玻璃緩慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸與NaOH溶液混合均勻的正確操作是________。
A.用溫度計小心攪拌 B.揭開硬紙片用玻璃棒攪拌
C.輕輕地振蕩燒杯 D.用套在溫度計上的環形玻璃棒輕輕地攪動
(4)實驗數據如下表:
①請填寫下表中的空白:
溫度 實驗 次數 | 起始溫度t1/℃ | 終止 溫度 t2/℃ | 溫度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地認為0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比熱容c=4.18 J/(g·℃),則中和熱ΔH = ______ (取小數點后一位)。
③中和熱測定實驗中,下列操作一定會降低實驗準確性的是________。
A.用滴定管(精量儀器,讀數保留到0.01)取所用酸堿溶液的體積
B.NaOH溶液在倒入小燒杯時,有少量濺出
C.大、小燒杯體積相差較大,夾層間放的碎泡沫塑料較多
D.測量HCl溶液的溫度計用水洗凈后才用來測NaOH溶液的溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業涉及固體燃料的氣化,需要研究CO2與CO之間的轉化。為了弄清其規律,讓一定量的CO2與足量碳在體積可變的密閉容器中反應:C(s)+CO2(g)![]() 2CO(g) H,測得壓強、溫度對CO、CO2的平衡組成的影響如圖所示:
2CO(g) H,測得壓強、溫度對CO、CO2的平衡組成的影響如圖所示:

回答下列問題:
(1)p1、p2、p3的大小關系是______________,欲提高C與CO2反應中CO2的平衡轉化率,應采取的措施為 。圖中a、b、c三點對應的平衡常數大小關系是____________。
(2)900 ℃、1.013 MPa時,1 mol CO2與足量碳反應達平衡后容器的體積為V,CO2的轉化率為_________,該反應的平衡常數K= 。
(3)將(2)中平衡體系溫度降至640 ℃,壓強降至0.1013 MPa,重新達到平衡后CO2的體積分數為50%。條件改變時,正反應和逆反應速率如何變化?_______,二者之間有何關系?____________________。
(4)一定條件下,在CO2與足量碳反應所得平衡體系中加入H2和適當催化劑,有下列反應發生:CO(g)+3H2(g)![]() CH4(g)+H2O(g) H1=-206.2 kJ/mol
CH4(g)+H2O(g) H1=-206.2 kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=-41.2 kJ/mol
CO2(g)+H2(g) H2=-41.2 kJ/mol
① 則二氧化碳與氫氣反應轉化為甲烷和水蒸氣的熱化學方程式是_________________。
② 已知298 K時相關化學鍵鍵能數據為:
化學鍵 | H—H | O—H | C—H |
|
E/(kJ·mol-1) | 436 | 465 | 413 | 1076 |
則根據鍵能計算,H1= ,它與上述實測值差異較大的原因可能是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com