
【題目】一定溫度下,在3個體積均為1.0 L的恒容密閉容器中反應2H2(g)+CO(g)![]() CH3OH(g) 達到平衡。下列說法正確的是( )
CH3OH(g) 達到平衡。下列說法正確的是( )
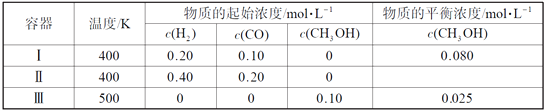
A. 該反應的逆反應放熱
B. 達到平衡時,容器Ⅰ中反應物轉化率比容器Ⅱ中的大
C. 達到平衡時,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的兩倍
D. 達到平衡時,容器Ⅲ中的正反應速率比容器Ⅰ中的大
【答案】D
【解析】根據表中Ⅰ、Ⅲ中數據知反應開始時Ⅰ中加入的H2、CO與Ⅲ中加入甲醇的物質的量相當,平衡時甲醇的濃度:Ⅰ>Ⅲ,溫度:Ⅰ<Ⅲ,即升高溫度平衡逆向移動,該反應正向為放熱反應,A項錯誤;Ⅱ相當于將容器Ⅰ的體積縮小二分之一,該反應正向為氣體物質的量減小的反應,增大壓強平衡正向移動,達到平衡時,容器Ⅰ中反應物轉化率比容器Ⅱ中的小,B項錯誤;Ⅰ和Ⅱ對比,Ⅱ相當于將容器Ⅰ的體積縮小二分之一,該反應正向為氣體物質的量減小的反應,增大壓強平衡正向移動,則Ⅱ中氫氣的濃度小于Ⅰ中氫氣濃度的2倍,Ⅲ和Ⅰ對比,平衡逆向移動,氫氣濃度增大,故達到平衡時,容器Ⅱ中c(H2)小于容器Ⅲ中c(H2)的兩倍,C項錯誤;溫度:Ⅲ>Ⅰ,當其他條件不變時,升高溫度反應速率加快,故達到平衡時,容器Ⅲ中的正反應速率比容器Ⅰ中的大,D項正確。


 快樂小博士鞏固與提高系列答案
快樂小博士鞏固與提高系列答案科目:高中化學 來源: 題型:
【題目】現有三組混合液體:①乙酸乙酯和乙酸鈉溶液,②乙醇和己醇,③碘化鈉和單質碘的水溶液。分離以上混合液的正確方法依次是
A. 蒸餾、萃取、分液 B. 分液、萃取、蒸餾 C. 分液、蒸餾、萃取 D. 萃取、蒸餾、分液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關苯甲酸重結晶實驗的說法錯誤的是
A. 溶解粗苯甲酸過程中,加熱、玻璃棒攪拌均能提高苯甲酸的溶解度
B. 苯甲酸溶解時,若加水加熱后仍有不溶物,說明該不溶物是不溶性雜質
C. 過濾時,趁熱過濾可防止苯甲酸晶體提前析出
D. 冷卻結晶時,溫度過低雜質將析出,故此時溫度不是越低越好
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】液體燃料電池相比于氣體燃料電池具有體積小等優點。一種以液態肼(N2H4)為燃料的電池裝置如圖所示,該電池用空氣中的氧氣作為氧化劑,KOH溶液作為電解質溶液。下列關于該電池的敘述正確的是

A. b極發生氧化反應
B. a極的反應式:N2H4+4OH--4e-=N2↑+4H2O
C. 放電時,電流從a極經過負載流向b極
D. 其中的離子交換膜需選用陽離子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的氯氣通入30 mL濃度為10 mol/L的氫氧化鈉濃溶液中,加熱少許時間后均完全反應溶液中形成NaCl、NaClO、NaClO3共存體系。下列判斷正確的是( )
A. Cl2在反應中僅作氧化劑
B. ClO3—中心原子采用sp2雜化
C. n(NaCl)∶n(NaClO)∶n(NaClO3)可能為11∶2∶1
D. 與NaOH反應的氯氣一定為0.15 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機反應中間體(M)的一種合成路線如下圖所示。
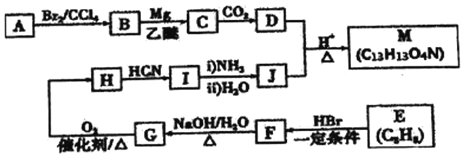
已知:①![]()
②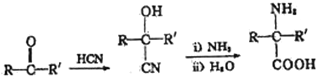 (R表示氫原子或烴基)
(R表示氫原子或烴基)
③標準狀況下,氣態烴A 的密度是H2的14倍。
④芳香族化合物H能發生銀鏡反應。
⑤M 中還有一個除苯環之外的環狀結構。
(1)B的名稱(系統命名)為________;H→I的反應類型為_________。
(2) E 中官能團的結構簡式為_________。
(3)F→G 的化學方程式為_________。
(4)D+J→M的化學方程式為__________。
(5) 寫出符合下列條件的J的所有同分異構體的結構簡式:_________ (不考慮立體異構)。
①苯環上連有-NO2 ②核磁共振氫譜有3個峰
(6) 結合已有知識和相關信息。寫出以CH3CHO和題中的物質為原料制備分子式為C6H10N2O2(含六元環)的物質的合成路線流程圖(無機試劑任用)。合成路線流程圖示例如下:_____________
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.均一穩定的分散系只有溶液
B.膠體和溶液、濁液的本質區別是能否產生“丁達爾效應”
C.一束平行光線照射FeCl3溶液時,從垂直于光線的方向可以看到一條光亮的通路
D.氫氧化鐵膠體能吸附水中的懸浮顆粒并沉降,起到凈水作用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫鐵礦燒渣的主要成分為 Fe2O3、Fe3O4,以及少量 SiO2、Al2O3 等。由硫鐵礦燒渣制備鐵紅(Fe2O3) 的一種工藝流程如下:

已知:還原焙燒時,大部分 Fe2O3、Fe3O4 轉化為 FeO。 幾種離子開始沉淀和完全沉淀時的 pH 如下表所示:

(1) “酸浸、過濾”步驟中所得濾液中的金屬陽離子有(填離子符號)______________。
(2)Fe 粉除調 pH 外,另一作用是___________;Fe 粉調節溶液的 pH 范圍為__________。
(3) 已知“沉鐵、過濾”中生成沉淀為碳酸鐵沉淀,則高溫條件下,“氧化”步驟中發生反應的化學方程式為______________。
(4) Fe2O3 也是赤鐵礦的主要成分,工業上若要得到 120t 純度為 93%生鐵需要含雜質 20%的(雜質不含鐵 元素)赤鐵礦的質量為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com