
【題目】下列說法正確的是( )
A. 氫元素的幾種核素均有質子和中子
B. 金剛石和C60互為同素異形體,且都屬于原子晶體
C. C2H6和C3H8 互為同系物
D. 化合物(b) ![]() 、(d)
、(d) ![]() 、(p)
、(p) ![]() 的分子式均為C6H6,b的同分異構體只有d和p兩種
的分子式均為C6H6,b的同分異構體只有d和p兩種
 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:
【題目】某容器真空時,稱量其質量為60.4g,此容器充滿N2時總質量為66.0g,在相同狀況下,充滿另一氣體時,總質量為70g,那么該氣體可能是( )
A.Cl2B.O3C.SO2D.HCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水溶性離子是大氣顆粒物的主要成分,研究其化學組成對于治理大氣污染其有重大意義,某地區大氣顆粒物經采樣與必要的預處理后得試樣溶液。經離子色譜檢驗確定含有以下離子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同學對其再進行如下的實驗:

已知:在加熱與強堿性條件下,鋁單質可以將NO3-還原為氨氣。
回答下列問題:
(1)“氣體1“的電子式為_________。
(2)生成“沉淀1”的離子方程式為________。
(3)“沉定2”的成分是___________(填化學式)。
(4)“溶液3![]() 氣體2”的離子方程式為_________。
氣體2”的離子方程式為_________。
(5)根據上述實驗可推斷該地區大氣顆粒物中__________含量較低(填離子符號)。
(6)已知大氣顆粒物中各元素的行染主體如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主體 | 機動車尾氣 | 燃煤污染 | 海鹽離子 | 土壤揚塵 | 建筑粉塵 |
根據實驗結果可判斷該地區大氣顆粒物污染主體有___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中,肯定能說明金屬甲比金屬乙金屬性強的是( )
A.甲原子最外層電子數比乙原子最外層電子數少
B.甲原子電子層數比乙原子電子層數多
C.1mol甲從酸中置換生成的氫氣比1mol乙從酸中置換生成的氫氣多
D.常溫下,甲能與水反應生成氫氣,而乙不能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N2O和CO是環境污染性氣體,可在Pt2O+表面轉化為無害氣體,其反應為N2O(g)+CO(g) CO2(g)+N2(g) △H,有關化學反應的物質變化過程(圖1)及能量變化過程(圖2)如下:

下列說法正確的是( )
A.由圖1可知:△H1=△H+△H2
B.由圖2可知△H =-226 kJ/mol
C.為了實現轉化需不斷向反應器中補充Pt2O+和Pt2O2+
D.由圖2可知該反應正反應的活化能大于逆反應的活化能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2C2O4為二元弱酸。20℃時,配制一組c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物質的量濃度隨pH的變化曲線如圖所示。下列指定溶液中微粒的物質的量濃度關系一定正確的是

A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近幾年科學家發明的一種新型可控電池——鋰水電池,工作原理如圖所示。下列有關說法不正確的是( )

A. 石墨極發生的反應是2H2O+2e— === H2↑+2OH—
B. 有機電解質和水溶液不可以互換區域
C. 該裝置不僅可提供電能,還可得到清潔的氫氣
D. 標準狀況下產生22.4 L的氫氣時,正極消耗鋰的質量為14 g
【答案】D
【解析】A、根據圖示信息可知,石墨電極上產生H2,則石墨電極為正極,電極反應為:2H2O+2e=H2↑+2OH,故A正確;B、Li和有機電解質不反應,而Li和水反應,若Li和水接觸,會有部分化學能直接轉化為熱能,所以有機電解質和水溶液不可以換區域,故B正確;C、該原電池是將化學能轉化為電能的裝置,裝置不僅可提供電能,并且反應產物是氫氣,能提供氫能源,故C正確;D、金屬鋰是負極,故D錯誤。故選D。
【題型】單選題
【結束】
26
【題目】一種新型的“鋰-呼吸CO2電池”,結構如圖所示,下列說法不正確的是

A. 該裝置是化學能轉變為電能
B. 利用該技術可減少溫室氣體CO2的排放
C. 正極的電極反應為:2CO2 + 2e- = C2O42-
D. 每生成10.2g Li2C2O4,有0.2mol Li+從正極遷移至負極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水四氯化錫是無色易流動的液體。熔點-33℃,沸點114.1℃。遇潮濕空氣,水解而生成錫酸和氯化氫。下圖是實驗室制備無水四氯化錫并對產品蒸餾,制得純凈無水氧化錫的實驗設計(加熱及夾持裝置已略去)。
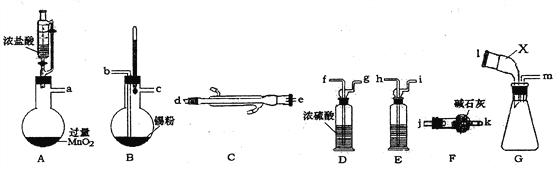
(1)裝置A中反生反應的離子方程式_______________________。
(2)上述實驗儀器口連接順序為__________________________________。
(3)裝置E中盛裝試劑的名稱為_________;上述實驗正確的操作順序為_____________。
①點燃裝置A處酒精燈;②點燃裝置B處酒精燈;③打開恒壓漏斗活塞。
(4)裝置G中儀器X的名稱為___________。裝置F的作用為_________________。
(5)將四氯化錫慢慢加水生成SnO2膠體和六氯合錫酸[H2[SnC16]],該反應的化學反應方程式為______________________。
(6)設計實驗測定鹽酸與MnO2反應的最低濃度,進行了如下操作:
I將裝置A中液體加熱至不再產生黃綠色氣體為止,冷卻過濾。
Ⅱ取上述濾液10mL稀釋到400mL
III取稀釋后溶液25.00mL加入指示劑進行滴定,滴定終點消耗0.2mol ·L-1的NaOH溶液19.25mL。
①上述條件下Mn2+開始沉淀的pH為5.2,則滴定時最好選用的指示劑為_____________。
②通過上述數據計算,鹽酸與MnO2反應的最低濃度為__________(結果保留兩位小數)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com